Перейти к:
Реконструкция протяжённых дефектов мочеточников с использованием участков тонкой и толстой кишки
https://doi.org/10.21886/2308-6424-2024-12-4-102-113
Аннотация
Распространённость протяжённых стриктур мочеточника за последние 10 лет прогрессивно увеличивается, что связано с ростом количества эндоскопических операций, расширением показаний к хирургическому лечению онкологических больных и осложнениями, вызванными лучевой терапией, или после лучевой терапии. Коррекция протяжённой стриктуры мочеточника при недостатке тканей мочевыделительной системы для замещения дефекта или вовлеченности их в патологический процесс требует заместительной реконструкции сегментом тонкой или толстой кишки. В данной обзорной статье освещены варианты реконструкций мочеточников с использованием участков подвздошной и толстой кишок, а также использование в качестве трансплантата аппендикса. В результате были проанализированы данные об эффективности, частоте послеоперационных осложнений, проведена оценка преимуществ и недостатков различных хирургических методик уретеропластики. Сделан вывод о необходимости проведения дальнейших научно-практических исследований и оценке отдалённых результатов для решения остающихся нерешённых проблем.
Ключевые слова
Для цитирования:
Котов С.В., Гаина О.В. Реконструкция протяжённых дефектов мочеточников с использованием участков тонкой и толстой кишки. Вестник урологии. 2024;12(4):102-113. https://doi.org/10.21886/2308-6424-2024-12-4-102-113
For citation:
Kotov S.V., Gaina O.V. Reconstruction of extended ureteral defects using sections of the ileum and colon. Urology Herald. 2024;12(4):102-113. (In Russ.) https://doi.org/10.21886/2308-6424-2024-12-4-102-113
Введение
Лечение протяжённых стриктур мочеточника остаётся актуальной проблемой в хирургии мочевыводящих путей. Постоянное увеличение частоты возникновения стриктур в основном связано с увеличением осложнений, возникающих после эндоурологических вмешательств. Протяжённые стриктуры мочеточника также являются осложнениями хирургического лечения гинекологических, колоректальных заболеваний, лучевой терапии, воспалительных заболеваний различного генеза (ретроперитонеальный фиброз, бильгарциоз, вторичный туберкулёз мочеполовой системы), а также могут являться результатом неудачной первичной реконструкции мочеточника [1 – 4]. При недостатке длины собственных тканей мочевыделительной системы для восстановления мочеточника, выраженном фиброзе и плохом кровоснабжении достичь должного результата возможно замещением протяженного дефекта участком кишечника.
Несмотря на большие достижения современной медицины, проблема выбора кишечного трансплантата при хирургическом лечении больных с протяжёнными стриктурами мочеточник остаётся нерешённой. Несомненно, подвздошно-кишечная реконструкция мочеточника является наиболее изученной методикой и чаще применяется в клинической практике. Однако ряд авторов утверждает, что реконфигурированный подвздошно-кишечный трансплантат по технике Yang-Monti предпочтительнее ввиду уменьшения площади абсорбируемой поверхности, что снижает риск метаболических осложнений. В ряде работ авторы демонстрируют реконструкцию мочеточника толстой кишкой, преимуществом которой является анатомическая близость кишки к мочеточнику, а также расположение вне поля облучения при лучевой терапии органов малого таза.
Цель исследования: проанализировать научный материал и продемонстрировать различные варианты оперативных вмешательств при протяжённых стриктурах мочеточника, эффективность и частоту осложнений на основании обзора современной медицинской литературы.
Алгоритм литературного поиска
Для достижения поставленной цели проведён обзор литературы в отечественных и иностранных базах данных ФЭМБ (Федеральная электронная медицинская библиотека), eLIBRARY, PubMed за период с 1912 по 2023 год. Стратегия поиска включала использование ключевых слов: «протяжённая стриктура мочеточника», «кишечная пластика мочеточника», «техника Yang-Monti», «толстокишечная пластика», «аппендикопластика мочеточника», «onlay-пластика мочеточника». Было проработано 679 литературных источников, в обзор включены 60 работ.
Заместительная подвздошно-кишечная пластика
На рубеже XIX и XХ веков стала рассматриваться возможность реконструкции обширных дефектов мочеточников. В 1894 году Finger предложил использовать тонкокишечный трансплантат на сосудистой ножке для замещения дефекта мочеточника. Первое клиническое применение подвздошной кишки для пластики протяжённой стриктуры мочеточника туберкулёзной этиологии было опубликовано G.E. Shoemaker в 1911 году [5]. Однако в то время представленная методика не получила распространения среди клиницистов. В дальнейшем хирургическое лечение протяжённых дефектов сводилось к имплантации мочеточника в тонкую кишку, но гораздо чаще — в сигмовидную или прямую.
Публикации D. Annis в 1953 году [6], M.P. Bitker и W.C. Baum в 1954 году [7][8], A.E. Goldstein в 1956 году [9] ознаменовали новый виток в реконструкции протяжённых стриктур мочеточников. С.А. Wells в 1956 году сообщил о 56 случаях использования подвздошной кишки в качестве трансплантата для замещения мочеточника [10]. В 1959 году W.E. Goodwin et al. (1959) предложили выполнять кишечную реконструкцию у пациентов с рецидивирующим нефролитиазом, а также разработали методики двухсторонней замены мочеточника одним кишечным трансплантатом, расположенным г- или 7-образно [11].
Накопленный опыт применения лапароскопических и роботизированных технологий привёл к значительному прогрессу в минимально инвазивном лечении стриктур мочеточников. I.S. Gill et al. в 2000 году сообщили о первой лапароскопической кишечной пластике мочеточника у пациента с уротелиальным раком верхней трети мочеточника и единственной почкой [12]. Позднее A. Sim et al. (2014) описали 4 случая лапароскопической замены мочеточника, выполненных полностью интракорпорально [13]. J.R. Wagner в 2008 году сообщил о роботической подвздошно-кишечной пластике мочеточника [14]. А.Д. Кочкин и соавт. (2022) представили результаты многоцентрового ретроспективного анализа 40 лапароскопических илеопластик мочеточника, что является самым крупным на сегодняшний день исследованием с применением малоинвазивных методик [15]. В 33 случаях произведена тотальная илеопластика, в остальных — субтотальная. Только у трёх пациентов были интраоперационные осложнения, распознанные и устраненные лапароскопически во время той же операции. В частности, повреждение почечной вены во время мобилизации лоханочно-мочеточникового сегмента произошло у одного пациента из-за значительного воспалительного процесса, а два повреждения кишечника произошли во время адгезиолизиса. У 35 пациентов не было послеоперационных осложнений, у двух пациентов было осложнение Clavien II и у трёх пациентов — осложнение Clavien III (подтекание мочи, кишечная непроходимость, странгуляция кишечной петли). Малоинвазивный хирургический доступ обладает рядом преимуществ, включая лучшую визуализацию, меньшую кровопотерю, меньший болевой синдром в послеоперационном периоде, лучший косметический эффект, более короткую госпитализацию и более быстрое возвращение к работе.
Частота ранних послеоперационных осложнений варьируется от 10 до 42,9% [16 – 18]. Важно отметить, что осложнения, соответствующие IIIb – IV группам по классификации Clavien-Dindo, отмечаются довольно редко [16][19]. Поздние послеоперационные осложнения выявляются с частотой 16 – 35% случаев [13][16][17]. В таблице 1 представлены характер и частота ранних и поздних осложнений согласно результатам наиболее крупных исследований.
Таблица 1. Ранние и поздние осложнения подвздошно-кишечной пластики
Исследование | Roth (2017) [20] | Monn (2018) [17] | Armatys (2009) [18] | Verduyckt (2002) [21] | Launer (2021) [22] | Zong (2019) [23] | Poujade (2020) [19] | |
Кол-во пациентов | 108 | 23 (ЛТ) | 81 | 91 | 18 | 46 | 23 | 21 |
Период наблюдения | 51 мес. (22 – 112) | 47 мес. (26 – 105) | 37 мес. (20 – 72) | 46,8 мес. (2 – 88) | 65 мес. (2 – 196) | 4,4 года (1 – 16 лет) | 45 мес. | 85 мес. (3 – 165) |
Ранние осложнения Clavien-Dindo I – Vb | ||||||||
I | 16 (14,8%) | 1 (4,3%) | 16 (19,7%) | 2 (4,4%) | 1 (4,8%) | |||
II | 3 (2,8%) | 2 (8,7%) | 2 (2,5%) | 49 | 7 | 25 (54,3%) | 6 | 5 (23,8%) |
IIIa | 7 (6,5%) | 2 (8,7%) | 4 (4,9%) | 17 | 7 (15,3%) | |||
IIIb | 2 (1,9%) | 0 | 2 (2,5%) | 2 | 5 | 8 (17,5%) | 2 (9,5%) | |
IVa | 2 (1,9%) | 1 (4,3%) | 0 | 8 | ||||
IVb | 1 (0,9%) | 0 | 0 | |||||
Отдалённые осложнения | ||||||||
Метаболические осложнения | 4 (3,7%) | 2 (8,7%) | 1 (1,2%) | 4 | 2 | 1 | ||
Почечная недостаточность | 2 (1,9%) | 1 (4,3%) | 1 (1,2%) | 1 | ||||
Нефрэктомия | 2 | 2 | 3 (6,5%) | |||||
Ревизия подвздошного трансплантата | 5 (10,9%) | |||||||
Слизистая обструкция | 2 (9,5%) | |||||||
Мочекаменная болезнь | 1 | 1 | 2 (9,5%) | |||||
Послеоперационная грыжа | 11 (10,2%) | 3 (13,0%) | 6 (7,4%) | 4 | 2 | |||
Кишечная непроходимость | 9 (8,3%) | 5 (21,7%) | 6 (7,4%) | |||||
Тонкокишечная непроходимость, требующая оперативного лечения | 3 (2,8%) | 3 (13,0%) | 1 (1,2%) | 4 | ||||
Рецидивирующие инфекции МВП | 2 | 6 | 2 | 4 (19,0%) | ||||
Стриктура анастомоза | 4 (3,7%) | 2 (2,5%) | 3 | 4 | 5 (10,9%) | |||
Свищ | 6 (5,6%) | 3 (13,0%) | 3 (3,7%) | 6 | 1 (2,2%) | |||
Раневая инфекция | 1 (1,2%) | 1 | 1 (2,2%) | |||||
Эффективность подвздошно-кишечной реконструкции мочеточника в основном оценивалась по отсутствию стриктур анастомозов или другого процесса, требующего повторной операции, и, по разным данным, составляет 72 – 100%. В таблице 2 представлены отдалённые результаты оценки почечной функции.
Таблица 2. Отдалённые функциональные результаты
Авторы и год публикации | Пациенты | Период наблюдения (мес.) | Почечная функция | ||
Улучшение (%) | Стабилизация (%) | Ухудшение (%) | |||
Koсot (2017) [24] | 157 | 54,1 (1 – 219) | 84,6 | 10,3 | 5,1 |
Roth (2017) [20] | 108 | 51 (22 – 112) | 32,3 | 52,8 | 14,9 |
Monn (2018) [17] | 104 | 47 (26 – 105) | 98,1 | 1,9 | |
Armatys (2009) [18] | 91 | 46,8 (2 – 88) | 74,7 | 25,3 | |
Xu (2016) [25] | 41 | (34 – 51) | 22 | 78 | |
Kim (2018) [26] | 31 | 23,6 (6,5 – 43,2) | 16,1 | 77,4 | 6,5 |
Kotov (2021) [27] | 25 | 51,3 (6 – 109) | 30,8 | 61,5 | 7,7 |
Zong (2019) [23] | 23 | 45 | 95,7 | 4,3 | |
Poujade (2020) [19] | 21 | 33,3 | 38,1 | 28,6 | |
Подвздошно-кишечная реконструкция мочеточника показала высокую эффективность в лечении протяжённых дефектов мочеточника, предлагая надёжную альтернативу постоянному дренированию или нефрэктомии. Операция имеет приемлемый профиль безопасности с низкой частотой серьёзных осложнений, что делает её предпочтительным выбором для многих пациентов.
Дальнейшее развитие данной методики связано с широким внедрением минимально инвазивных технологий, таких как лапароскопическая и роботизированная хирургия. Эти методы снижают хирургическую травматизацию и ускоряют восстановление пациентов. Малоинвазивные подходы также позволяют проводить операции с меньшими разрезами, что снижает риск инфекций и улучшает косметические результаты.
Илеопластика по технике Yang-Monti
Реконфигурация подвздошно-кишечного трансплантата посредством детубуляризации и поперечной ретубуляризации впервые предложена и применена W.H. Yang в 1993 году для создания эфферентного канала, имплантируемого в континентный резервуар после радикальной цистэктомии [28]. В 1997 году P.R. Monti в эксперименте на 10 собаках использовал аналогичную технику с той же целью. Полученная трубка обеспечивала континенцию, лёгкую катетеризацию и низкий уровень осложнений [29]. Первый клинический опыт использования реконфигурированного подвздошно-кишечного трансплантата для пластики мочеточника представили B. Ali-El-Dein и M.A. Ghoneim в 2003 году [30]. Авторы продемонстрировали результаты 10 реконструкций и указали на ряд преимуществ данного метода: необходимость короткого сегмента кишки, что уменьшает площадь адсорбируемой поверхности, следовательно, устраняются метаболические осложнения, в результате реконфигурации подвздошно-кишечного трансплантата формируется лоскут подходящего поперечного сечения и образуются края, свободные от брыжейки, что облегчает формирование анастомоза проксимально и антирефлюксную имплантацию дистально.
Важные дополнения к описанной выше методике внёс Б.К. Комяков (2016), рекомендовав клиновидную резекцию участка кишки размером 4 см между выделенными фрагментами для реконструкции, представлено на рисунке 1 [31]. При этом оптимальная длина оставшихся подвздошно-кишечных фрагментов должна составлять 3,0 – 3,5 см. В результате данной модификации, после разворота детубуляризированных фрагментов, концы участков занимают место удалённого ранее кишечного участка, и в зоне их соединения не возникает натяжения брыжеек и перегиба трансплантата. После сшивания фрагментов и ретубуляризации образуется ровная кишечная трубка с хорошим просветом.
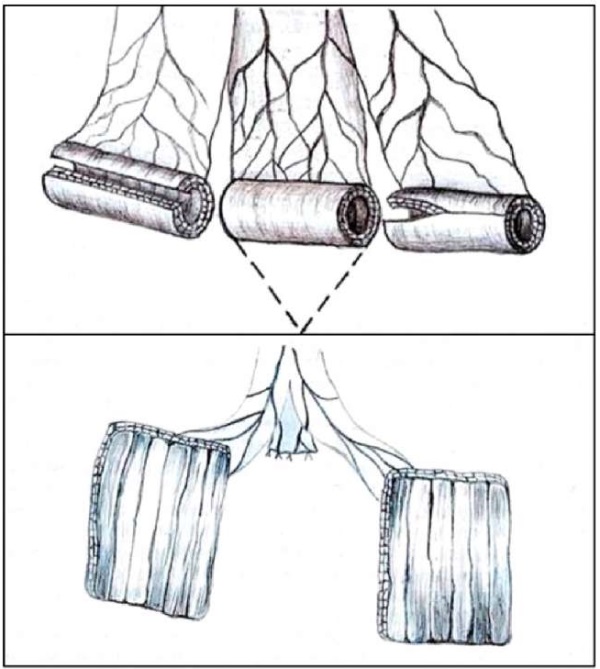
Рисунок 1. Этапы подвздошно-кишечной пластики мочеточника
по технике Yang-Monti [31]
Эффективность операции, по разным данным, варьируется от 60 до 100%, что чаще всего обусловлено объёмом исследуемой когорты. В таблице 3 представлены ранние и поздние послеоперационные осложнения. В данные таблицы включены опубликованные исследования, проведенные на взрослых пациентах, за исключением отдельных клинических случаев (до 3 кейсов).
Таблица 3. Ранние и поздние послеоперационные осложнения
Авторы | Количество пациентов | Период наблюдения (мес.) | Количество сегментов | АР | Ранние послеоперационные осложнения | Поздние послеоперационные осложнения | |||||||||||
ИМП | ПКН | Несостоятельность (затёк) | Пролонгированное дренирование | РИ | Стриктура | Бес. гидр. (отр. дин.) | Симпт. гидр. | Дилат. трансп. | Пост. дрен. | ИМП | Вентр. гр. | Повт. опер. | |||||
Ali-el-Dein (2003) [30] | 10 | 9,6 (6 – 13) | 2, 3 | + | 6 | 1 | |||||||||||
Stefens (2010) [32] | 18 | 4,2 (0,5 – 8,0) | 1, 2, 3, 4 | + | 4 | 2 | 2 | 2 | 5 | 3 | 1 | ||||||
Esmat (2012) [33] | 16 | (6 – 36) | 2, 3 | + | 3 | 1 | 1 | 1 | |||||||||
Ordorica (2013) [34] | 13 | 44 (12 – 78) | + | 4 | 1 | 1 | 1 | 2 | |||||||||
Maigaard (2015) [35] | 5 | 41 (13 – 62) | 2 | 3 | 3 | 1 | 1 | 1 | 2 | 1 | 1 | ||||||
Komyakov (2016) [31] | 5 | 1 – 2 | 1 | 1 | |||||||||||||
Ali-El-Dein (2021) [36] | 36 | 68 (12 – 215) | + | 1 | 1 | 1 | 8 | 36 | 10 | 1 | |||||||
Poza (2022) [37] | 3 | 1 | 2 | 2 | 1 | 1 | |||||||||||
Lin (2022) [38] | 7 | 36,7 | 5 – 6 | + | 2 | 1 | 7 | 7 | 1 | 1 | |||||||
Примечание. АР — антирефлюксный механизм; ИМП — инфекция мочевыводящих путей;
ПКН — послеоперационная кишечная непроходимость; РИ — раневая инфекция;
Бес. гидр. — бессимптомный гидронефроз; Симпт. гидр. — симптоматический гидронефроз;
Дилат трансп. — дилатация трансплантата; Пост. дрен. — постоянное дренирование;
Вентр. гр. — вентральная грыжа; Повт. опер. — повторная операция
Из данных таблицы можно выделить несколько основных моментов: риск осложнений, таких как раневая инфекция, несостоятельность анастомоза, значительно выше, нежели в аналогичных исследованиях по кишечным реконструкциям неизменённым фрагментом кишки. Также высока частота постоянного дренирования в связи с сохраняющимися нарушениями уродинамики при отсутствии видимой обструкции. При этом большинство оперативных вмешательств до сих пор выполняется открытым доступом, что влияет на сроки послеоперационного восстановления, а в отдалённом периоде способствует образованию послеоперационных вентральных грыж.
Вопрос о сохранности перистальтики в реконфигурированном трансплантате остаётся дискутабельным, как и о её адекватности в случае сохранения. Высокая частота дилатации трансплантата и сохраняющийся гидронефроз с ипсилатеральной стороны, представленные в исследованиях, указывают на нарушения уродинамики верхних мочевых путей. Хоть авторы и утверждают об отсутствии влияния подобных изменений на почечную функцию, вероятно, требуется больший период наблюдения с оценкой раздельной почечной функции.
Пластика мочеточника с использованием толстой кишки
В 1957 году J. Orfali впервые успешно выполнил заместительную пластику левого мочеточника сигмовидной кишкой [39]. В 1958 году E. Tossatti применил толстокишечный трансплантат для пластики правого мочеточника [40]. Однако толстокишечная пластика мочеточника не получила широкого клинического распространения ввиду большого диаметра кишки, высокой контаминации, значительного слизеобразования, высокой вероятности метаболического ацидоза и потенциального риска малигнизации [41][42]. Частичное решение описанных выше проблем появилось с публикацией W.H. Yang в 1993 году [28]. В 1996 году J. Pope и M.O. Koch (1996) с применением принципа Yang описали случай замены протяжённого дефекта мочеточника реконфигурированным трансплантатом восходящей ободочной кишки у пациента после ортотопической подвздошно-кишечной деривации и лучевой терапии [43]. При этом авторы выделяют ряд преимуществ использования толстой кишки для реконструкции. К ним отнесли анатомическую близость кишки к мочеточнику, забрюшинное расположение восходящей и нисходящей ободочной кишки и положение вне поля облучения, которое обычно используется при большинстве злокачественных образований малого таза. B. Ubrig в 2001 году продемонстрировал свои первые результаты интерпозиции реконфигурированного толстокишечного трансплантата для пластики мочеточника и создания пиелоколонокутанеостомы. В 2003 году опубликованы обновлённые результаты исследования по 7 пациентам. Авторы отмечают, что при среднем периоде наблюдения 23 месяца отсутствуют метаболические осложнения, риск повышенного слизеобразования невелик, а калибр используемого трансплантата адекватен при использовании 3 см участка толстой кишки для реконфигурации [44][45]. M. Castellan и R. Gosalbez отметили преимущества использования толстой кишки в своём отчёте о клинических случаях применения тонкой и толстой кишки. У пациента после пластики мочеточника реконфигурированной толстой кишкой осложнений не было выявлено, функция почки стабилизировалась на уровне 1,6 мг/дл (2,0 мг/дл до операции) при периоде наблюдения 3,25 года [46].
Исследование D. Lazica и A. Ubrig было обновлено в 2012 году и включало 14 пациентов, которым была проведена колопластика мочеточников. Медиана периода наблюдения составила 52,4 месяца (от 7 до 136). Методика оперативного пособия представлена (рис. 2) [47]. В послеоперационном периоде 4 пациентам потребовалось длительное дренирование: у двоих — в связи с экстравазацией мочи, у одного пациента — вследствие сохраняющегося болевого синдрома и ещё одному — из-за образовавшегося свища. У 4 пациентов сохранялся гидронефроз без признаков обструкции. При оценке отдалённых результатов выяснилось, что 8 пациентов скончались: 5 — от прогрессирования онкологического заболевания, 3 — от сердечно-сосудистых осложнений. 3 пациентам потребовалась повторная установка стента в среднем через 38 недель. Инфекция мочевыделительной системы, требующая стационарного лечения антибактериальными препаратами, отмечена у 3 пациентов через 4 недели, а также через 3 месяца и 112 месяцев.
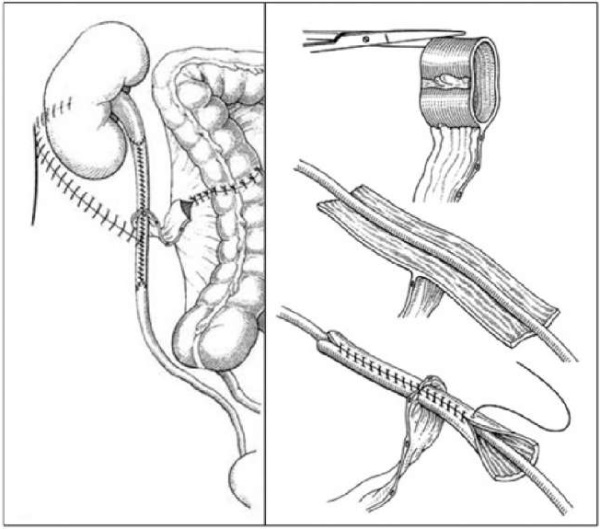
Рисунок 2. Этапы заместительной толстокишечной пластики мочеточника [47]
На сегодняшний день из опубликованных литературных источников найдены лишь отдельные клинические случаи и последовательно представленное исследование одного центра. По мнению авторов приведённых работ, результаты оперативных вмешательств с применением толстой кишки были удовлетворительными, и в сравнении с использованием подвздошной кишки в качестве трансплантата, толстокишечные сегменты лучше подходят для пациентов, которым проводилась лучевая терапия. Также трансплантаты толстой кишки образуют более длинный и широкий просвет, что предотвращает пузырно-мочеточниковый рефлюкс и обеспечивает сохранение функции почек. Однако толстокишечный сегмент имеет нестабильное кровоснабжение, обилие сальниковых отростков, что вызывает затруднения в формировании анастомозов. Кроме того, недостатком данного участка являются высокая бактериальная контаминация, специфические заболевания, такие как дивертикулёз и язвенный колит, что ограничивает его использование.
Аппендикопластика мочеточника
Впервые о возможности реконструкции мочеточника аппендиксом сообщил A.E. Melnikoff в 1912 году [48 – 50]. Первое же клиническое применение аппендикоуретеропластики было описано R. Kuss, J. Camey и коллегами в 1959 году. В этом исследовании были продемонстрированы случаи аппендикоуретеропластики у пациентов с протяжённым дефектом поясничного отдела мочеточника и ятрогенными стриктурами, возникшими вследствие оперативных вмешательств при мочекаменной болезни [50].
В ретроспективном обзоре H. Dagash et al. (2008) был проведён анализ 10 случаев пластики протяжённых стриктур мочеточников с использованием аппендикса. Выполнены девять реконструкций правого мочеточника и одна — левого. При медиане наблюдения в 16 месяцев (1 – 72) осложнений не выявлено, за исключением одного пациента. В данном случае отмечено ухудшение почечной функции. Эффективность составила 90% [49].
Б.К. Комяков и соавт. в 2019 году опубликовали результаты самого крупного исследования, включавшего 26 пациентов. Одному из пациентов после огнестрельного ранения была проведена аппендикопластика верхней трети правого мочеточника, тогда как у 25 человек выполнена реконструкция нижней трети мочеточника. В последних 22 случаях была применена модификация операции с удалением участка купола слепой кишки для увеличения просвета аппендикса. Период наблюдения составлял от 1 до 21 года. Интраоперационных осложнений не выявлено. В послеоперационном периоде гидронефроз лёгкой степени развился у двух пациентов. Из 22 пациентов, оперированных по новой методике, у двух был диагностирован пузырно-мочеточниковый рефлюкс. У 4 пациентов развилась стриктура уретероаппендиксного анастомоза, эндоскопическое лечение оказалось неэффективным, что потребовало повторной хирургической коррекции [50].
Аппендикоуретеропластика обладает рядом преимуществ, таких как анатомическое соответствие диаметра аппендикса и мочеточника, что обеспечивает хороший пассаж мочи и минимизирует риск обструкции. Перистальтика аппендикса помогает продвигать мочу и снижает риск рефлюкса. Небольшая площадь всасывания аппендикса уменьшает вероятность метаболических осложнений. Аппендикс легко мобилизируется благодаря достаточной длине и ширине брыжейки, а узкий просвет препятствует застою мочи, что снижает риск инфекций и образования камней. Долгосрочные результаты показывают восстановление нормального пассажа мочи и единичные рецидивы стриктуры [50 – 53].
Однако у аппендикоуретеропластики есть и недостатки. Основным ограничением является доступность аппендикса: пациенты после аппендэктомии не могут быть кандидатами для этой операции. Также возможно несоответствие размеров аппендикса и дефекта мочеточника, что возможно определить лишь интраоперационно.
Пластика мочеточника аппендиксом является перспективной и эффективной методикой для реконструкции мочеточника. Современные исследования и разработки в области минимально инвазивной хирургии обещают дальнейшее улучшение результатов операций и снижение риска осложнений.
Onlay-методика реконструкции мочеточника с использованием детубуляризированного участка подвздошной кишки или аппендикса
В последнее время стали набирать популярность onlay-пластики мочеточника с использованием различных аутотрансплантатов для пластики протяжённых стриктур мочеточника с сохранённым просветом. С этой целью могут использоваться различные ткани, такие как буккальная и лингвальная слизистые, аутовенозные трансплантаты, слизистая мочевого пузыря, детубуляризированный участок тонкой кишки или аппендикса. В рамках данного обзора мы рассмотрим onlay-методики реконструкции кишечными трансплантатами.
Впервые использование лоскута из подвздошной кишки продемонстрировано I. Gomez-Avraham et al. в 1994 году [54]. Авторы выполнили реконструкцию верхней и средней трети мочеточника у 4 пациентов, при этом все вмешательства были успешными, а метаболические осложнения отсутствовали. В работе изложена методика оперативного пособия (рис. 3). После мобилизации толстой кишки мочеточник выделялся в области стриктуры только по передней поверхности с целью сохранения васкуляризации. Далее выполнялся продольный разрез, превышающий протяжённость стриктуры на 1 см в проксимальном и на 1 см в дистальном направлениях. Подходящий сегмент подвздошной кишки резецировался с сохранением сосудистой ножки. Проходимость кишечника восстанавливалась межкишечным анастомозом. Трансплантат проводили через окно брыжейки толстой кишки и адаптировали к дефекту мочеточника. С этой целью продольно иссекали две трети противобрыжеечного края, а на проксимальном и дистальном концах выполняли разрез в виде буквы «V». Заднемедиальный край сшивали рассасывающимся шовным материалом 4/0. Далее устанавливался мочеточниковый стент и ушивалась вторая губа анастомоза.
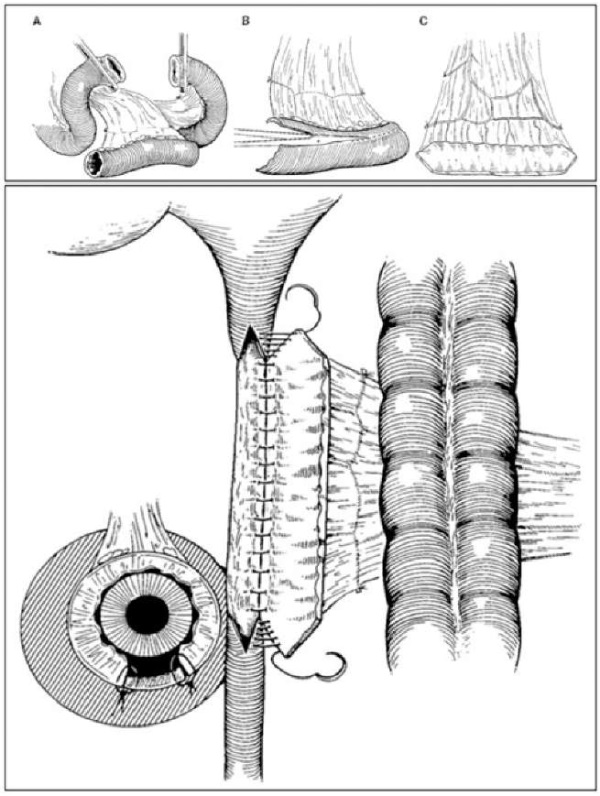
Рисунок 3. Этапы onlay-пластики мочеточника тонкой кишкой [54]
R. Ordorica et al.в 2014 году представили результаты пластики 13 пациентов, которым в общей сложности восстановили 16 мочеточников [37]. Реконфигурированный илеотрансплантат по технике Yang-Monti применён в 7 случаях, ещё 7 реконструкций выполнено детубуляризированным фрагментом подвздошной кишки по типу onlay, в 2 случаях пластика выполнена аппендикулярным лоскутом. Средний период наблюдения составил 44 месяца (12 – 78). В раннем послеоперационном периоде осложнений не выявлено. В 25% случаях отмечались клинические признаки пиелонефрита с ипсилатеральной стороны. Все пациенты в целом успешно перенесли реконструкцию (что подтверждено рентгенологическим и радиоизотопным исследованием) без осложнений со стороны кишечника или мочевыделительной системы (за исключением двух пациентов). У одной пациентки с двусторонней пластикой по Yang-Monti через 5 лет выполнена односторонняя нефрэктомия (1 из 7 пластик Yang-Monti — 14,2%). У пациента, перенёсшего двустороннюю onlay-пластику на дистальных отделах облученного мочеточника, развился свищ в слепой карман Гартмана. Свищ был закрыт открытой хирургической ревизией через 9 месяцев. Однако через 44 месяца потребовалась повторная реконструкция мочеточника (1 из 9 пластик onlay — 11,1%). Восстановление контрлатерального мочеточника с использованием той же методики было успешным, осложнений не выявлено.
Onlay-пластика аппендикулярным лоскутом впервые выполнена E. Reggio et al. в 2008 году [55]. Ими успешно произведена лапароскопическая реконструкция шестисантиметровой стриктуры мочеточника ятрогенной этиологии (после КУЛТ). В 2015 году опубликованы отдаленные результаты лечения данного пациента с дополнением ещё 5 клинических наблюдений [56]. Субъективный и объективный успехи были отмечены у четырёх пациентов (66,7%) при средней продолжительности наблюдения 16,3 (3,8 – 30,4) месяца. У двух пациентов болевой синдром в поясничной области с ипсилатеральной стороны рецидивировал. При дообследовании отмечена положительная динамика гидронефроза в одном случае, во втором — сохранялось умеренное расширение, радиоизотопное исследование также продемонстрировало сохранную почечную функцию и период полувыведения, составляющий 4 минуты. В связи с сохранением болевого синдрома в обоих случаях установлен нефростомический дренаж. Выполнены рентгеноконтрастные методы исследования и уретероскопия, подтвердившие отсутствие рецидива стриктуры и полную проходимость мочеточника. Учитывая сохраняющийся болевой синдром на фоне пережатой нефростомы, пациенты в дальнейшем перенесли лапароскопический уретеролиз и операцию Boari, при этом уретероцитоанастомоз сформирован проксимальнее аппендикулярного лоскута. В одном случае при динамическом наблюдении сохранился умеренный болевой синдром в поясничной области, проявляющийся эпизодически. У второго пациента болевой синдром сохранялся без динамики, и ему была выполнена лапароскопическая нефрэктомия. Однако через 6 месяцев вновь стали возникать периодические боли в пояснице.
J. Wang et al. (2020) представили свой опыт 9 onlay-пластик мочеточников аппендикулярным лоскутом: 5 вмешательств выполнено лапароскопическим доступом, 4 — роботическим [57]. В течение 30 дней после операции не возникло послеоперационных осложнений высокой степени (Clavien-Dindo III и IV). Объективный успех составил 100% (у всех пациентов наблюдались эндоскопические и рентгенологические признаки разрешения стриктур мочеточника). Субъективный показатель успеха составил 88,9% (у одной пациентки развился рецидивирующий дискомфорт в пояснице, а в почечной лоханке был обнаружен конкремент размером 0,5 см). В 2022 году та же группа авторов опубликовала отдалённые результаты этой когорты пациентов [58]. Все пациенты были бессимптомными, эффективность составила 100%.
S. Cheng et al. (2021) представили опыт лапароскопической и роботической пластики мочеточника с использованием лоскутной методики у 53 пациентов [59]. Диапазон протяжённости стриктуры составлял 2 – 6 см. В общей сложности выполнено 28 реконструкций лоханочным лоскутом, 9 — аппендикулярным и 16 — лоскутом из слизистой оболочки языка, при этом 33 операции выполнены лапароскопически и 20 — роботически. При среднем сроке наблюдения 12,8 месяца общий показатель успеха составил 94,3%. В послеоперационном периоде после реконструкции аппендикулярным лоскутом наблюдалось одно осложнение Clavien-Dindo IIIa-миграция стента, что потребовало замены последнего.
В России пластику мочеточника лоскутом аппендикса у пяти пациентов продемонстрировали Б.Г. Гулиев, Б.К. Комяков и соавт. (2023) [60]. Интраоперационных осложнений не было. В послеоперационном периоде у одного пациента наблюдалась лихорадка и у одного — парез кишечника, разрешившийся консервативно. При среднем сроке наблюдения 13,5 (6,2 – 24,4) месяца эффективность операции составила 100%. Уродинамика верхних мочевыводящих путей (ВМП) восстановилась полностью у 3 пациентов, сравнительно улучшилась — у 2, пациенты оставались бессимптомными.
Заключение
Onlay-методики реконструкции мочеточника при сохранной проходимости стремительно набирают популярность, демонстрируют высокую эффективность и минимальную частоту осложнений. При протяжённых стриктурах с облитерацией просвета наиболее предпочтительным вариантом лечения является заместительная подвздошно-кишечная пластика. Данная операция проверена временем, обладает высокой эффективностью и умеренной частотой прогнозируемых и известных осложнений, успешно выполняется повсеместно, в том числе в малоинвазивном исполнении. Илеопластика по технике Yang-Monti демонстрирует большую частоту хирургических осложнений, обусловленных техническими особенностями выполнения (несостоятельность и стриктуры анастомозов), также не до конца ясна её функциональная эффективность ввиду частых случаев выявления обструктивной симптоматики при сохранной проходимости трансплантата. Пластика с использованием восходящей и нисходящей толстой кишки не может быть рекомендована на данном этапе вследствие недостаточного опыта. Для решения оставшихся неясных вопросов необходимо проведение дальнейших научно-практических исследований с оценкой отдалённых результатов.
Список литературы
1. Комяков Б.К., Ал-Аттар Т.Х., Гулиев Б.Г. Кишечная и аппендикулярная реконструкция мочеточников. Урология. 2021;(2):14-20. DOI: 10.18565/urology.2021.2.14-20
2. Лоран О.Б., Синякова Л.А., Серегин А.В., Твердохлебов Н.Е., Довлатов З.А., Текеев М.А. Использование изолированных сегментов кишечника в оперативном лечении лучевых повреждений мочевыводящих путей. Урология. 2012;(2):20-24.
3. Зубань О.Н., Скорняков С.Н., Арканов Л.В., Новиков Б.И., Бородин Э.П., Чотчаев Р.М., Еремеев Д.Ю. Энтеропластика протяженных стриктур мочеточника туберкулезного и другого генеза. Урология. 2014;(4):10-15.
4. Xiong S, Zhu W, Li X, Zhang P, Wang H, Li X. Intestinal interposition for complex ureteral reconstruction: A comprehensive review. Int J Urol. 2020;27(5):377-386. DOI: 10.1111/iju.14222
5. Shoemaker GE. VIII. Removal of the Ureter with a Tuberculous Kidney. Ann Surg. 1911;53(5):696-698. DOI: 10.1097/00000658-191105000-00008
6. Annis D. Replacement of the ureter by small intestine; an experimental study. Proc R Soc Med. 1952;45(8):483-484. PMID: 12993794; PMCID: PMC1987582
7. Bitker MP. Les uretero-ileo-plasties. J. Urol. 1954;60:474-540.
8. Baum WC. The clinical use of terminal ileum as a substitute ureter. J Urol. 1954;72(1):16-33. DOI: 10.1016/S0022-5347(17)67535-9
9. Abeshouse BS, Goldstein AE, Silberstein H, Yildiran C. Experimental studies of ileoureteral substitutes in dogs. J Urol. 1956;76(4):371-379. DOI: 10.1016/S0022-5347(17)66707-7
10. Wells CA. The use of the intestine in urology, omitting ureterocolic anastomosis. Br J Urol. 1956;28(4):335-350; discussion, 406-416. DOI: 10.1111/j.1464-410x.1956.tb04783.x
11. Goodwin WE, Winter CC, Turner RD. Replacement of the ureter by small intestine: clinical application and results of the ileal ureter. J Urol. 1959;81(3):406-418. DOI: 10.1016/S0022-5347(17)66035-X
12. Gill IS, Savage SJ, Senagore AJ, Sung GT. Laparoscopic ileal ureter. J Urol. 2000;163(4):1199-1202. PMID: 10737495
13. Sim A, Todenhöfer T, Mischinger J, Halalsheh O, Boettge J, Rausch S, Aufderklamm S, Stenzl A, Gakis G, Schwentner C. Totally intracorporeal replacement of the ureter using whole-mount ileum. J Endourol. 2014;28(10):1165-1167. DOI: 10.1089/end.2014.0169
14. Wagner JR, Schimpf MO, Cohen JL. Robot-assisted laparoscopic ileal ureter. JSLS. 2008;12(3):306-309. PMID: 18765059; PMCID: PMC3015870
15. Kochkin A, Tokas T, Gallyamov E, Biktimirov R, Sanzharov A, Sergeev V, Popov S, Gözen AS. Laparoscopic totally intracorporeal ileal ureter replacement: a multi-institutional study. Minim Invasive Ther Allied Technol. 2022;31(1):119-126. DOI: 10.1080/13645706.2020.1762094
16. Chung BI, Hamawy KJ, Zinman LN, Libertino JA. The use of bowel for ureteral replacement for complex ureteral reconstruction: long-term results. J Urol. 2006;175(1):179-183; discussion 183-184. DOI: 10.1016/S0022-5347(05)00061-3
17. Monn MF, Roth JD, Bihrle R, Mellon MJ. Long term outcomes in the use of ileal ureter for radiation-induced ureteral strictures. Int Urol Nephrol. 2018;50(8):1375-1380. DOI: 10.1007/s11255-018-1904-z
18. Armatys SA, Mellon MJ, Beck SD, Koch MO, Foster RS, Bihrle R. Use of ileum as ureteral replacement in urological reconstruction. J Urol. 2009;181(1):177-181. DOI: 10.1016/j.juro.2008.09.019
19. Poujade L, Branchereau J, Rigaud J, Perrouin-Verbe MA. Ileal ureter replacement: Early morbidity and long-term results. Prog Urol. 2021;31(6):357-367. DOI: 10.1016/j.purol.2020.10.002
20. Roth JD, Monn MF, Szymanski KM, Bihrle R, Mellon MJ. Ureteral Reconstruction With Ileum: Long-term Follow-up of Renal Function. Urology. 2017;104:225-229. DOI: 10.1016/j.urology.2017.02.026
21. Verduyckt FJ, Heesakkers JP, Debruyne FM. Long-term results of ileum interposition for ureteral obstruction. Eur Urol. 2002;42(2):181-187. DOI: 10.1016/s0302-2838(02)00266-x
22. Launer BM, Redger KD, Koslov DS, Sax-Bolder AN, Higuchi TT, Windsperger AP, Flynn BJ. Long-term Follow Up of Ileal Ureteral Replacement for Complex Ureteral Strictures: Single Institution Study. Urology. 2021;157:257-262. DOI: 10.1016/j.urology.2021.07.012
23. Zhong W, Hong P, Ding G, Yang K, Li X, Bao J, Bao G, Cui L, Men C, Li Z, Zhang P, Chu N, Zhou L. Technical considerations and outcomes for ileal ureter replacement: a retrospective study in China. BMC Surg. 2019;19(1):9. DOI: 10.1186/s12893-019-0472-1
24. Kocot A, Kalogirou C, Vergho D, Riedmiller H. Long-term results of ileal ureteric replacement: a 25-year single-centre experience. BJU Int. 2017;120(2):273-279. DOI: 10.1111/bju.13825
25. Xu YM, Feng C, Kato H, Xie H, Zhang XR. Long-term Outcome of Ileal Ureteric Replacement With an Iliopsoas Muscle Tunnel Antirefluxing Technique for the Treatment of Long-segment Ureteric Strictures. Urology. 2016;88:201-206. DOI: 10.1016/j.urology.2015.11.005
26. Kim A, Nam W, Song SH, Jeong IG, Hong B. Use of the Ileum for Ureteral Stricture and Obstruction in Bilateral, Unilateral, and Single-kidney Cases. Urology. 2018;111:203-207. DOI: 10.1016/j.urology.2017.08.008
27. Котов С.В., Гуспанов Р.И., Юсуфов А.Г., Гаина О.В., Лапин И.В. Отдаленные результаты заместительной кишечной пластики протяженных стриктур мочеточников. 9-летний опыт одной клиники. Урология. 2023;(4):5-11. DOI: 10.18565/urology.2023.4.5-11
28. Yang WH. Yang needle tunneling technique in creating antireflux and continent mechanisms. J Urol. 1993;150(3):830-834. DOI: 10.1016/s0022-5347(17)35625-2
29. Monti PR, Lara RC, Dutra MA, de Carvalho JR. New techniques for construction of efferent conduits based on the Mitrofanoff principle. Urology. 1997;49(1):112-115. DOI: 10.1016/S0090-4295(96)00503-1
30. Ali-el-Dein B, Ghoneim MA. Bridging long ureteral defects using the Yang-Monti principle. J Urol. 2003;169(3):1074-1077. DOI: 10.1097/01.ju.0000050151.66653.cc
31. Комяков Б.К., Гулиев Б.Г., Очеленко В.А., Ал-Аттар Т.Х., Мханна Х.М. Технические особенности кишечной пластики мочеточников. Часть 4: уретеропластика реконфигурированными кишечными сегментами по YANG-MONTI. Урология. 2016;(5):21-26.
32. Steffens JA, Anheuser P, Reisch B, Treiyer AE. Harnleiterrekonstruktion mit rekonfigurierten Ileumsegmenten nach Yang-Monti. Prospektiver 4-Jahres-Bericht [Ureteric reconstruction with reconfigured ileal segments according to Yang-Monti. A 4-year prospective report]. Urologe A. 2010;49(2):262-267. (In German). DOI: 10.1007/s00120-009-2177-z
33. Esmat M, Abdelaal A, Mostafa D. Application of Yang-Monti principle in ileal ureter substitution: is it a beneficial modification? Int Braz J Urol. 2012;38(6):779-785; discussion 785-787. DOI: 10.1590/1677-553820133806779
34. Ordorica R, Wiegand LR, Webster JC, Lockhart JL. Ureteral replacement and onlay repair with reconfigured intestinal segments. J Urol. 2014;191(5):1301-1306. DOI: 10.1016/j.juro.2013.11.027
35. Maigaard T, Kirkeby HJ. Yang-Monti ileal ureter reconstruction. Scand J Urol. 2015;49(4):313-318. DOI: 10.3109/21681805.2014.882980
36. Ali-El-Dein B, El-Hefnawy AS, D' Elia G, El-Mekresh MM, Shokeir AA, Gad H, Bazeed MA. Long-term Outcome of Yang-Monti Ileal Replacement of the Ureter: A Technique Suitable for Mild, Moderate Loss of Kidney Function and Solitary Kidney. Urology. 2021;152:153-159. DOI: 10.1016/j.urology.2020.09.061
37. Poza A, Marzullo L, García G, Reig C. Reparación de lesiones ureterales complejas: presentación de tres casos clínicos y análisis de las diferentes opciones terapéuticas [Surgical repair of complex ureteral injuries: three clinical cases and analysis of different technical approaches.]. Arch Esp Urol. 2022;75(1):77-81. (In Spanish). PMID: 35173069
38. Lin CW, Chen JC, Huang WJ, Lin TP. Whole ureter replacement with Yang-Monti principle: successful treatment of challenging conditions. BMC Urol. 2022;22(1):198. DOI: 10.1186/s12894-022-01150-0
39. Кан Д.В. Кишечная пластика мочеточника. М.: Медицина; 1968.
40. Tosatti E. Plastiche intestinali in urologia [Enteroplasty in urology]. Minerva Urol. 1958;10(3):51-54. (In Italian). PMID: 13565841
41. Koch MO, Gurevitch E, Hill DE, McDougal WS. Urinary solute transport by intestinal segments: a comparative study of ileum and colon in rats. J Urol. 1990;143(6):1275-1279. DOI: 10.1016/s0022-5347(17)40254-0
42. Tscholl R, Tettamanti F, Zingg E. Ileal substitute of ureter with reflux-plasty by terminal intussusception of bowel: animal experiments and clinical experience. Urology. 1977;9(4):385-389. DOI: 10.1016/0090-4295(77)90211-4
43. Pope J, Koch MO. Ureteral replacement with reconfigured colon substitute. J Urol. 1996;155(5):1693-1695. PMID: 8627855
44. Ubrig B, Waldner M, Roth S. Reconstruction of ureter with transverse retubularized colon segments. J Urol. 2001;166(3):973-976. PMID: 11490258
45. Ubrig B, Roth S. Reconfigured colon segments as a ureteral substitute. World J Urol. 2003;21(3):119-122. DOI: 10.1007/s00345-003-0320-9
46. Castellan M, Gosalbez R. Ureteral replacement using the Yang-Monti principle: long-term follow-up. Urology. 2006;67(3):476-479. DOI: 10.1016/j.urology.2005.09.005
47. Lazica DA, Ubrig B, Brandt AS, von Rundstedt FC, Roth S. Ureteral substitution with reconfigured colon: long-term followup. J Urol. 2012;187(2):542-548. DOI: 10.1016/j.juro.2011.09.156
48. Melnikoff AE. Sur le replacement de l’uretere par anse isolee de l’intestine grele. Rev Clin Urol. 1912;1:601-603.
49. Dagash H, Sen S, Chacko J, Karl S, Ghosh D, Parag P, Mackinnon AE. The appendix as ureteral substitute: a report of 10 cases. J Pediatr Urol. 2008;4(1):14-19. DOI: 10.1016/j.jpurol.2007.08.004
50. Komyakov B, Ochelenko V, Guliev B, Shevnin M. Ureteral substitution with appendix. Int J Urol. 2020;27(8):663-669. DOI: 10.1111/iju.14268
51. Jang TL, Matschke HM, Rubenstein JN, Gonzalez CM. Pyeloureterostomy with interposition of the appendix. J Urol. 2002;168(5):2106-2107. DOI: 10.1016/S0022-5347(05)64306-6
52. Richter F, Stock JA, Hanna MK. The appendix as right ureteral substitute in children. J Urol. 2000;163(6):1908-1912. PMID: 10799226
53. Komatz Y, Itoh H. A case of ureteral injury repaired with appendix. J Urol. 1990;144(1):132-133. DOI: 10.1016/s0022-5347(17)39391-6
54. Gomez-Avraham I, Nguyen T, Drach GW. Ileal patch ureteroplasty for repair of ureteral strictures: clinical application and results in 4 patients. J Urol. 1994;152(6 Pt 1):2000-2004. DOI: 10.1016/s0022-5347(17)32290-5
55. Reggio E, Richstone L, Okeke Z, Kavoussi LR. Laparoscopic ureteroplasty using on-lay appendix graft. Urology. 2009;73(4):928.e7-10. DOI: 10.1016/j.urology.2008.06.034
56. Duty BD, Kreshover JE, Richstone L, Kavoussi LR. Review of appendiceal onlay flap in the management of complex ureteric strictures in six patients. BJU Int. 2015;115(2):282-287. DOI: 10.1111/bju.12651
57. Wang J, Xiong S, Fan S, Yang K, Huang B, Zhang D, Zhu H, Ji M, Chen J, Sun J, Zhang P, Li X. Appendiceal Onlay Flap Ureteroplasty for the Treatment of Complex Ureteral Strictures: Initial Experience of Nine Patients. J Endourol. 2020;34(8):874-881. DOI: 10.1089/end.2020.0176
58. Wang J, Li Z, Fan S, Xiong S, Yuan C, Meng C, Zhang J, Zhang X, Zhang P, Ji M, Chen J, Yang K, Li X. Robotic ureteroplasty with appendiceal onlay flap: an update on the outcomes of 18-month follow-up. Transl Androl Urol. 2022;11(1):20-29. DOI: 10.21037/tau-21-840
59. Cheng S, Fan S, Wang J, Xiong S, Li X, Xu Y, Li Z, Guan H, Zhang P, Zhu H, Huang C, Zhang L, Yang K, Li X, Zhou L. Laparoscopic and robotic ureteroplasty using onlay flap or graft for the management of long proximal or middle ureteral strictures: our experience and strategy. Int Urol Nephrol. 2021;53(3):479-488. DOI: 10.1007/s11255-020-02679-5
60. Гулиев Б.Г., Комяков Б.К., Авазханов Ж.П., Поваго И.А. Onlay пластика протяженных стриктур мочеточника. Урология. 2023;1(1):92-100. DOI: 10.18565/urology.2023.1.92-100
Об авторах
С. В. КотовРоссия
Котов Сергей Владиславович — д-р мед. наук, профессор.
Москва
Конфликт интересов:
Нет
О. В. Гаина
Россия
Гаина Оксана Владимировна.
Москва
Конфликт интересов:
Нет
Рецензия
Для цитирования:
Котов С.В., Гаина О.В. Реконструкция протяжённых дефектов мочеточников с использованием участков тонкой и толстой кишки. Вестник урологии. 2024;12(4):102-113. https://doi.org/10.21886/2308-6424-2024-12-4-102-113
For citation:
Kotov S.V., Gaina O.V. Reconstruction of extended ureteral defects using sections of the ileum and colon. Urology Herald. 2024;12(4):102-113. (In Russ.) https://doi.org/10.21886/2308-6424-2024-12-4-102-113














































