Перейти к:
Новый подход к применению слизистой полости рта в реконструктивной хирургии уретры: микрографты
https://doi.org/10.21886/2308-6424-2022-10-1-70-83
Аннотация
Введение. Лечение пациентов со «сложными стриктурами» уретры является актуальной проблемой реконструктивной урологии. После неоднократных операций возможности повторного использования собственных тканей ограничены. Ведётся поиск новых источников пластического материала (различные ауто-, алло- и ксенотрансплантаты) для реконструктивных операций на уретре.
Цель исследования. Изучить возможность применения микрографтов слизистой полости рта для формирования уретральной площадки при многоэтапном лечении больных с протяжёнными стриктурами уретры.
Материалы и методы. В экспериментальной части исследования оценивали возможность приживления микрографтов слизистой полости рта и формирования эпителиальной площадки при гетеротопической трансплантации в условиях экспериментальной модели. Cамцам крыс Wistar (22 особи) массой 300 – 400 г после в/м седации выполняли кожную рану. Для ограничения контракции раны использовали раневую камеру диаметром 12 мм. Производили забор трансплантата слизистой полости рта диаметром 6 мм. После префабрикации трансплантат измельчали до фрагментов < 1 мм2. Полученные микрографты с компонентами фибрин-тромбинового клея наносили на рану. На 45-е сутки сформировавшуюся площадку иссекали для гистологического исследования. В клинической части исследования 4 пациентам с рецидивными стриктурами пенильного отдела уретры выполнены реконструктивные операции с формированием уретральной площадки с использованием микрографтов слизистой полости рта. Средняя протяжённость стриктур составляла 7,5 ± 1,2 см с участками выраженного сужения и облитерации просвета. На первом этапе лечения формировали уретральную площадку. Подготовку ложа уретральной площадки и забор трансплантата слизистой полости рта осуществляли по стандартной методике. Подготовку микрографтов слизистой полости рта и их имплантацию проводили на основе методики, разработанной в экспериментальной части исследования. Через 6 месяцев выполняли тубуляризацию неоуретры. Результаты лечения оценивали каждые 3 месяца (урофлоуметрия, ультразвуковое исследование, рентгенография, PROM-USS) после завершающего этапа оперативного лечения. Медиана наблюдения составила 9 месяцев (3 – 18 месяцев).
Результаты. К 15-м суткам у 16 из 22 (72,7%) крыс наблюдались очаговые разрастания многослойного неороговевающего эпителия. К 45-м суткам наблюдалось полное заживление раны в основном за счёт эпителия полости рта. Площадь полученной площадки составила 78 ± 12 мм2. В клинической части исследования к 6-му месяцу после первого этапа лечения у всех больных (n = 4) сформировалась уретральная площадка, покрытая многослойным плоским неороговевающим эпителием полости рта без выраженных рубцовых деформаций, достаточная для формирования неоуретры. Всем пациентам выполнена тубуляризация уретры. После удаления катетера у всех мужчин восстановилось самостоятельное мочеиспускание. Через 9 месяцев (медиана наблюдения, n = 3) максимальная скорость мочеиспускания составила 22,7 ± 4,2 мл/с, объём остаточной мочи — 34,8 ± 2,2 мл, суммарный балл PROM-USS — 7,4 ± 1,2, сохраняется достаточный просвет уретры. Все пациенты отметили высокую удовлетворённость результатами лечения.
Заключение. Микрографты слизистой полости рта хорошо приживаются при гетеротопической трансплантации (72,7%) с формированием эпителиального пласта на поверхности раны по площади, превышающего исходную площадь всех микрографтов в 3 раза. Первый клинический опыт использования микрографтов слизистой полости рта показывает возможность применения данной технологии в реконструктивной хирургии уретры, особенно при «сложных» стриктурах уретры при дефиците пластического материала.
Ключевые слова
Для цитирования:
Шибаев А.Н., Павлова Ю.В., Базаев В.В., Подойницын А.А., Султанов Д.И., Шинкарев А.Д., Сулейманов Р.С. Новый подход к применению слизистой полости рта в реконструктивной хирургии уретры: микрографты. Вестник урологии. 2022;10(1):70-83. https://doi.org/10.21886/2308-6424-2022-10-1-70-83
For citation:
Shibaev A.N., Pavlova Yu.V., Bazaev V.V., Podoinitsyn A.A., Sultanov D.I., Shinkarev A.D., Suleimanov R.S. A new approach to use of oral mucosa in reconstructive urethral surgery: micrografts. Urology Herald. 2022;10(1):70-83. (In Russ.) https://doi.org/10.21886/2308-6424-2022-10-1-70-83
Введение
Лечение пациентов со стриктурами уретры является актуальной проблемой реконструктивной урологии [1][2][3]. Внедрение в широкую практику трансплантатов слизистой полости рта для замещения дефектов уретры значительно улучшило результаты лечения и качество жизни этой категории больных [4]. Доступность, хорошая адаптация к влажной среде и манипуляционные характеристики, а также низкая морбидность донорских участков сделали в настоящее время слизистую оболочку полости рта предпочтительным трансплантатом для реконструкции уретры [5][6][7][8]. В связи с этим существенно изменились подходы к реконструкции протяжённых, множественных и рецидивных стриктур уретры, значительно снизив количество двухэтапных пластических операций [6][8].
Однако в практике любого уретрального хирурга встречаются больные с так называемыми «сложными стриктурами», когда отсутствие в достаточном объёме доступных, здоровых, надёжных местных тканей для реконструкции уретры делает невозможным выполнение одноэтапного оперативного лечения [9][10]. Это, как правило, наблюдается у пациентов с множественными неудачными реконструкциями в анамнезе, особенно после коррекции гипоспадии и при лихен-склерозе. Применение трансплантата слизистой полости рта в качестве материала для создания уретральной площадки также доминирует над другими методиками. Однако запланированные двухэтапные пластики зачастую превращаются в многоэтапные с бесконечной чередой ревизионных или корректирующих операций. По литературным данным, от 26 до 50% больных со «сложными стриктурами» требуют проведения дополнительных корректирующих этапов [11][12]. Наиболее частой причиной этого является контрактура трансплантата слизистой полости рта (более 22%) [13].
После неоднократных операций возможности повторного использования аутологичных трансплантатов (лоскутов) нередко бывают ограничены. Это заставляет реконструктивных хирургов искать новые источники пластического материала (различные ауто-, алло- и ксенотрансплантаты, синтетические материалы). В последнее время в таких ситуациях всё чаще пытаются использовать различные тканеинженерные конструкции [14][15]. Однако эффективность использования этих материалов в реконструктивной хирургии уретры на данном этапе оставляет желать лучшего. Кроме того, в настоящее время применение тканеинженерных конструкций с использованием клеточных технологий в клинической практике ограничено законодательно [16], но основными факторами, сдерживающими развитие данного направления и внедрение его в клиническую практику, является трудоёмкость и высокая стоимость технологий [14].
Альтернативную методику предложил C.P. Meek et al., который в 1958 году выдвинул теорию о краевой регенерации тканей, продемонстрировав возможность быстрого заживления обширных кожных поражений при использовании большого количества микротрансплантатов кожи (микрографтов) размером менее 1 – 2 мм2, существенно меньшей суммарной площади по сравнению с площадью раны [17]. В настоящее время микрографты успешно применяются в комбустиологии, дерматологии, стоматологии, ортопедии, лечении хронических ран различной этиологии [18][19][20][21][22][23][24]. В реконструктивной урологии данный подход к замещению дефектов нижних мочевыводящих путей опробован лишь в эксперименте [25][26][27][28].
Цель исследования: изучить возможность применения микрографтов слизистой полости рта для формирования уретральной площадки при многоэтапном лечении больных с протяжёнными стриктурами уретры.
Материалы и методы
Исследование, одобренное локальным независимым комитетом по этике ГБУЗ МО МОНИКИ им. М.Ф. Владимирского (Протокол № 8 от 13.06.2019), состояло из двух частей — экспериментальной и клинической. В первой части исследования оценивали возможность приживления микрографтов слизистой полости рта и формирования эпителиальной площадки при гетеротопической трансплантации в условиях экспериментальной модели.
Экспериментальная часть исследования. Эксперимент выполняли в соответствии с этическими нормами обращения с животными, принятыми Европейской конвенцией по защите позвоночных животных, используемых для исследовательских и иных научных целей, Федерацией европейских ассоциаций по науке о лабораторных животных и Международным советом по науке о лабораторных животных. Использовали 22 самца крыс Wistar массой 300 – 400 г (питомник ФГБУН НЦБМТ ФМБА, Россия). Животных содержали в условиях вивария на свободном пищевом режиме, включали в эксперимент после акклиматизации сроком в 14 дней. После в/м седации раствором тилетамина и золазепама — «Zoletil»® 100 («Virbac» S.A., Carros, France) в дозе 20 мг/кг с добавлением ксилазина — «Ксила»® (Interchemie werken «De Adelaar» BV, Castenray, The Netherlands) в дозе 4 мг/кг в асептических условиях на холке животных выполняли полнослойную кожную рану диаметром 15 мм, дно раны — фасция m. carnosus. Для поддержания влажной среды, ограничения контракции раны и заживления кожным эпителием использовали раневую камеру по методике, описанной K. Nuutila et al. [29]. Камеры изготавливали из биосовместимого фотополимера Med 610 («Stratasys Ltd.», Rehovot, Israel) методом 3D-печати (ООО «ИТК Эндопринт», Москва, РФ). Внутренний диаметр камеры составлял 12 мм. Камеру фиксировали ко дну раны и краям кожи узловыми швами Prolene 2/0 («Ethicon» Inc., Johnson & Johnson Company, Cincinnati, OH, USA) (рис. 1).
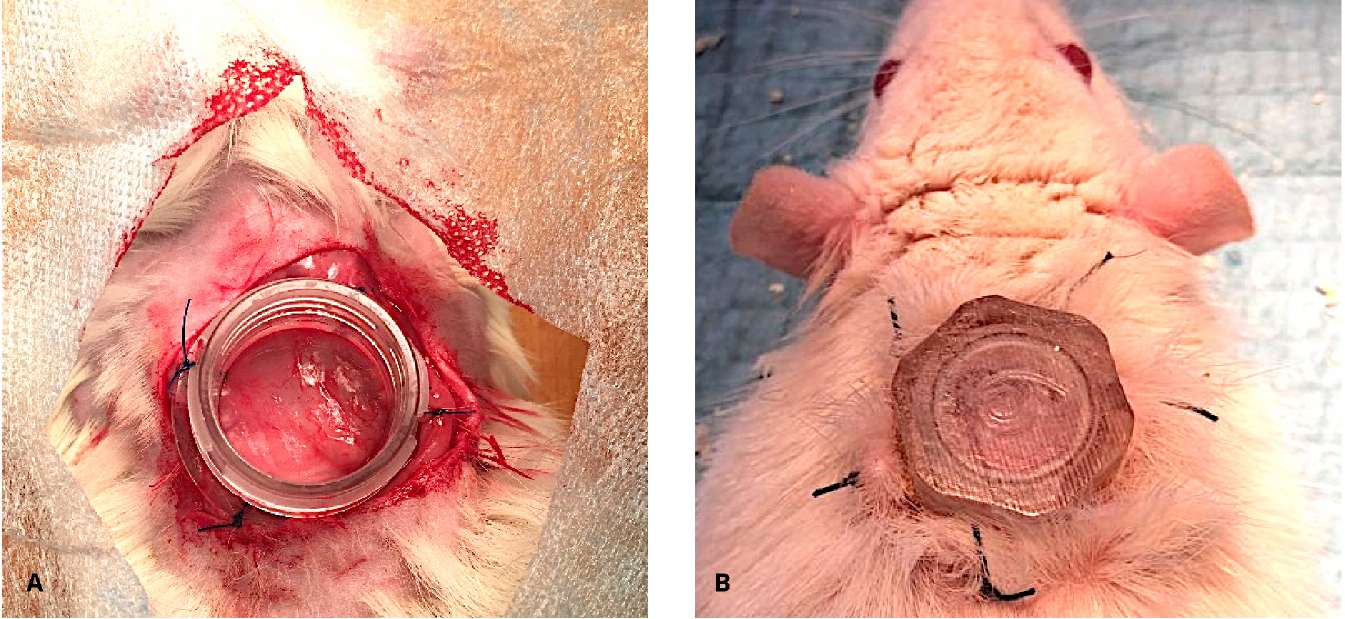
Рисунок 1. Раневая камера фиксирована к полнослойной кожной ране на спине крысы (А, В)
Figure 1. Wound chamber is placed transcutaneously on the dorsum of a rat (А, В)
После этого производили забор слизистой в полости рта. Полость рта крысы обрабатывали водным раствором хлоргекседина. После гидропрепаровки — 0,25% раствором прокаина — «Novocaine» (ООО «Гротекс», Санкт-Петербург, РФ) перфоратором Dermal Punch («Miltex» Inc., York, PA, USA) забирали участок слизистой полости рта диаметром 6 мм (соотношение площади трансплантата к площади внутри раневой камеры составило 1:4). Рану во рту не ушивали (рис. 2).
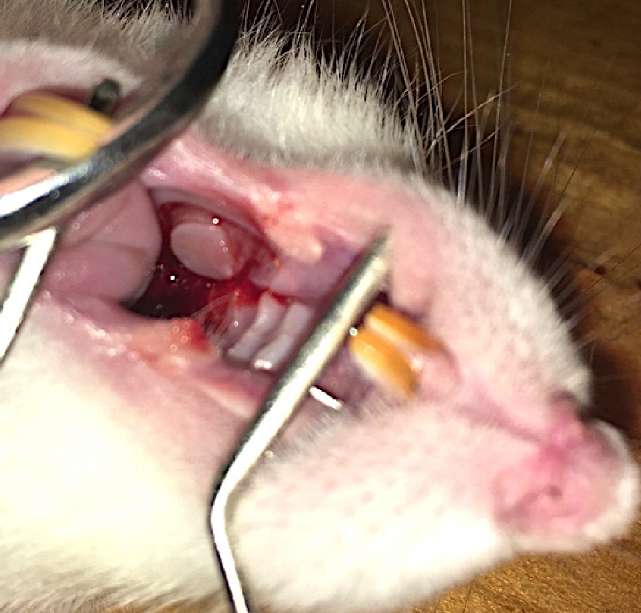
Рисунок 2. Забор слизистой полости рта
Figure 2. Oral mucosa graft harvesting
Трансплантат промывали в растворе антибиотиков, содержащем Гентамицин 100 мг/л (ОАО «Дальхимфарм», Хабаровск, РФ) и Ванкомицин 1000 мг/л (АО «Фарм-Синтез», Санкт-Петербург, РФ), очищали от подлежащего жира и механически измельчали в 1 мл раствора антибиотиков до фрагментов < 1 – 2 мм в стерильной чашке Петри (рис. 3). После измельчения избыток растворов удаляли. Полученные микрографты разделяли на две равные части и в разных пробирках смешивали с компонентами фибрин-тромбинового медицинского хирургического клея «Криофит» (ООО «Плазма-ФТК», Зеленоград, Москва, РФ). Затем поочерёдно вносили компоненты клея со взвешенными в них микрографтами в рану (рис. 4).

Рисунок 3. Микрографты слизистой полости рта
Figure 3. Oral mucosa micrografs

Рисунок 4. Микрографты слизистой полости рта с фибрин-тромбиновым клеем в ране
Figure 4. Oral mucosa micrografts with fibrin-thrombin glue in the wound
В послеоперационном периоде животным проводили антибактериальную терапию — 10% раствор Энрофлоксоцина («ALPOVET» Ltd., Сyprus) 1 мг/кг в/м в течение 7 дней. Перевязки под в/м седацией осуществляли 1 раз в 3 дня. При каждой перевязке проводили визуальную оценку раны — общего состояния, количества и характера экссудата, состояния микрографтов. Раневую камеру сохраняли максимально долго. При прорезывании более половины кожных швов раневую камеру удаляли. После удаления кольца (и далее на каждой перевязке) фиксировали размеры раны линейкой. На 15-е и 30-е сутки проводили панч-биопсию из участков раны. Животных выводили из эксперимента на 45-е сутки избыточным введением препаратов для наркоза. Измеряли площадь эпителизированной площадки. Иссекали всю раневую поверхность с прилежащей кожей единым блоком. Образцы тканей фиксировали в 10% нейтральном буферном растворе формалина, далее готовили серийные срезы по стандартному протоколу. Выполняли окраску 5 мкм срезов гематоксилином и эозином. При гистологическом исследовании оценивали степень воспалительной реакции, формирование сосудистой сети, формирование грануляционной ткани, приживление микрофагов, площадь разрастания эпителия, его зрелость. Гистологические изображения были получены с помощью программного обеспечения Leica Application Suite для светового микроскопа Leica OFC450C («Leica Microsystems» GmbH, Wetzlar, Germany).
Клиническая часть исследования. В клинической части исследования после подписания информированного согласия четырём пациентам с протяжёнными стриктурами уретры выполнены реконструктивные операции с формированием уретральной площадки и использованием микрографтов слизистой полости рта.
У всех мужчин стриктуры локализовались в пенильном отделе и являлись рецидивными. Средняя протяжённость стриктур составляла 7,5 ± 1,2 см. У одного из пациентов пенильная уретра была стенозирована на всём протяжении до меатуса. У трёх из четырёх были участки облитерации просвета, у одного — протяжённо выраженное сужение (< 2 мм) (рис. 5).
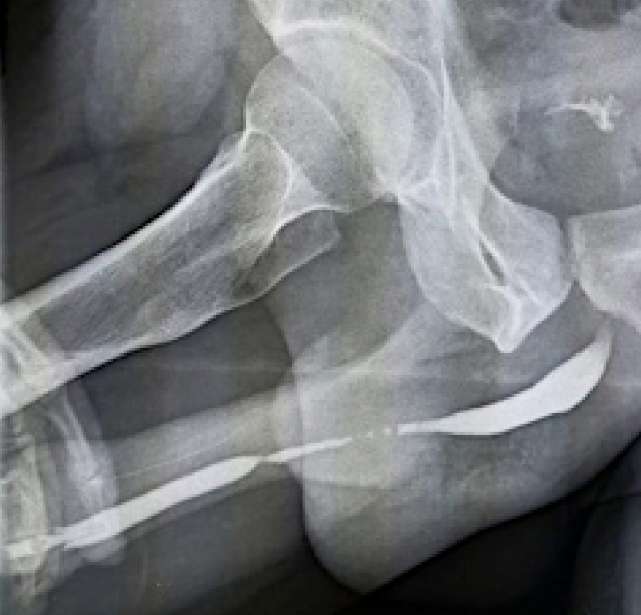
Рисунок 5. Восходящая уретрограмма: протяжённая стриктура пенильного отдела уретры
Figure 5. Retrograde urethrography: penile urethral stricture
На момент начала лечения у всех больных отсутствовало самостоятельное мочеиспускание, длительность пребывания цистостомы — от 6 до 12 месяцев. При оценке качества жизни при помощи опросника EuroQoL questionnaire (EQ-5D) у всех пациентов отмечено выраженное снижение показателей до 0,64 ± 0,05 (максимальное значение данного показателя равно 1). Оценку симптомов с использованием опросника Patient-Reported Outcome Measure for Urethral Stricture Surgery questionnaire (PROM-USS) перед операцией не проводили в связи с отсутствием самостоятельного мочеиспускания.
У всех больных на первом этапе лечения формировали уретральную площадку с использованием микрографтов слизистой полости рта на основе методики, разработанной в экспериментальной части исследования. Под общим обезболиванием выделяли пенильный отдел уретры на всём протяжении, просвет уретры вскрывали до неизмененной стенки в обоих направлениях. После ревизии и иссечения изменённой уретры со склерозированным спонгиозным телом формировали наружные отверстия уретростом (проксимального и дистального сегментов уретры). Кожу полового члена с фасцией Бака фиксировали, отступая 1,5 – 2 см от средней линии с каждой стороны, формируя таким образом границы ложа для трансплантации микрографтов слизистой полости рта. Забор трансплантата слизистой полости рта осуществляли по стандартной методике. Расчёт его площади проводили на основании измерений сформированного ложа (в соотношении 1:4). Дальнейшую подготовку микрографтов и их имплантацию проводили по методике, описанной выше (рис. 6).
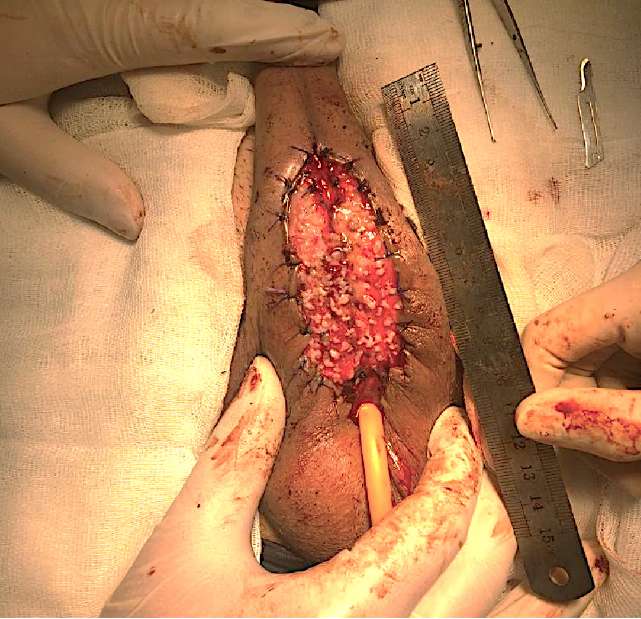
Рисунок 6. Первый этап уретропластики: формирование уретральной площадки
Figure 6. Staged urethroplasty: stage 1 — urethral plate formation
В послеоперационном периоде поддерживали поверхность раны во влажном состоянии. Через 6 месяцев после оценки состояния площадки выполняли второй этап пластики уретры — тубуляризацию. При этом выполняли панч-биопсию уретральной площадки перфоратором Dermal Punch («Miltex Inc.», York, PA, USA) диаметром 1 мм с последующим гистологическим исследованием. При тубуляризации уретры, если ширина уретральной площадки составляла менее 2,5 см, делали дополнительную аугментирующую вентральную вставку из трансплантата слизистой полости рта по методике onlay. Результаты лечения оценивали каждые 3 месяца (УФМ, УЗИ мочевого пузыря с определением остаточной мочи, уретрография, оценка симптомов при помощи опросника PROM-USS) после завершающего этапа оперативного лечения. Медиана наблюдения составила 9 (3 – 18) месяцев.
Методы статистического анализа. Статистическую обработку данных проводили с помощью пакета программ IBM® SPSS Statistics 26 («SPSS: An IBM Company», IBM SPSS Corp., Armonk, NY, USA). Для выявления различий значений показателей использовали непараметрический критерий Mann-Whitney. При проверке гипотез использован уровень значимости — p < 0,05.
Результаты
В ходе экспериментальной части ни одно животное не исключено из исследования ранее запланированных сроков. У большей части животных (18 из 22) к 21-м суткам эксперимента швы, фиксирующие раневую камеру, прорезались, в связи с чем камера была удалена. Наблюдение за этими животными было продолжено согласно протоколу до 45 суток.
К 15-м суткам у 16 из 22 (72,7%) крыс наблюдались очаговые разрастания многослойного неороговевающего эпителия (рис. 7А). Активно гранулирующая поверхность раны покрыта множеством округлых очагов эпителизации из микрографтов, не сливающихся в единый эпителиальный пласт (рис. 7В).
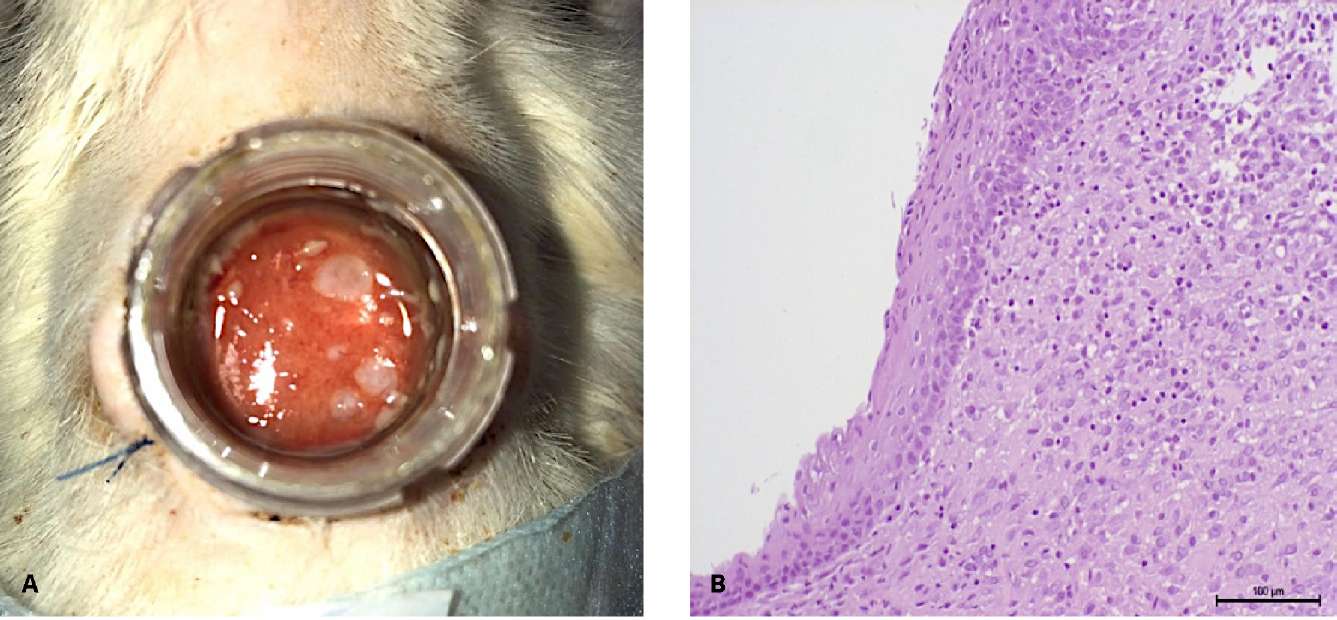
Рисунок 7. 15-е сутки наблюдения: А — рана с очагами эпителизации;
В — очаговые разрастания многослойного плоского неороговевающего эпителия
полости рта (гематоксилин-эозин, ув. ×200)
Figure 7. Follow-up day 15: A — type of wound: epithelialization sites;
B — focal growths non-keratinized stratified squamous epithelium
(hematoxylin-eosin, magn. ×200)
У части животных (n = 5) с 7-х суток поверхность раны была покрыта фибринозно-гнойными наложениями, под которыми также наблюдалась эпителизация многослойным неороговевающим эпителием.
К 30-м суткам имела место эпителизация раны многослойным плоским неороговевающим эпителием (эпителий полости рта) у 15 из 22 (68,2%) крыс (рис. 8). При этом ещё у 2 (9,1%) животных наблюдалось формирование в толще грануляционной ткани раны эпителиальных микрокист, выстланных тем же многослойным плоским эпителием и содержащих кератозные массы.
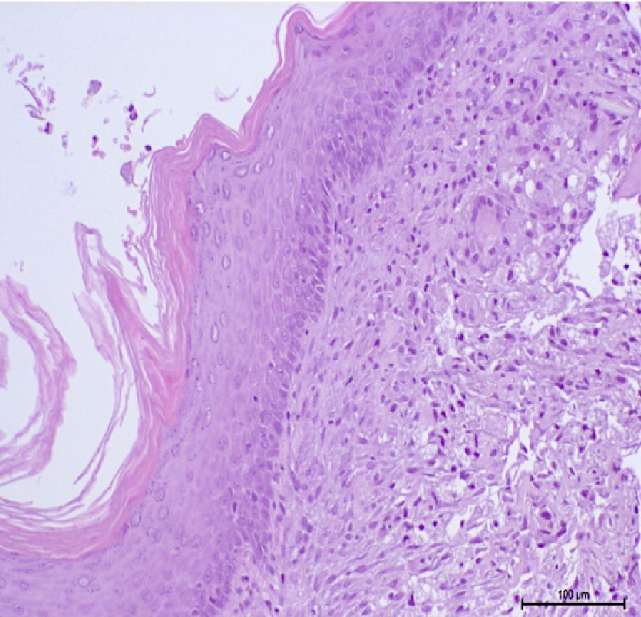
Рисунок 8. 30-е сутки наблюдения: формирование эпителиального слоя
многослойного плоского неороговевающего эпителия
полости рта под налетом фибрина (гематоксилин-эозин, ув. ×200)
Figure 8. Follow-up day 30: formation nonkeratinized stratified squamous epithelial layer
under a fibrin coating (hematoxylin-eosin, magn. ×200)
К 45-м суткам наблюдалось полное заживление раны с эпителизацией за счёт эпителия полости рта с очаговым гиперпаракератозом. Однако базальная пластинка эпителия на данном этапе достоверно не определялась. Площадь полученной площадки из эпителия полости рта составила 78 ± 12 мм2, что в среднем в 3 раза больше площади исходного трансплантата (рис. 9).
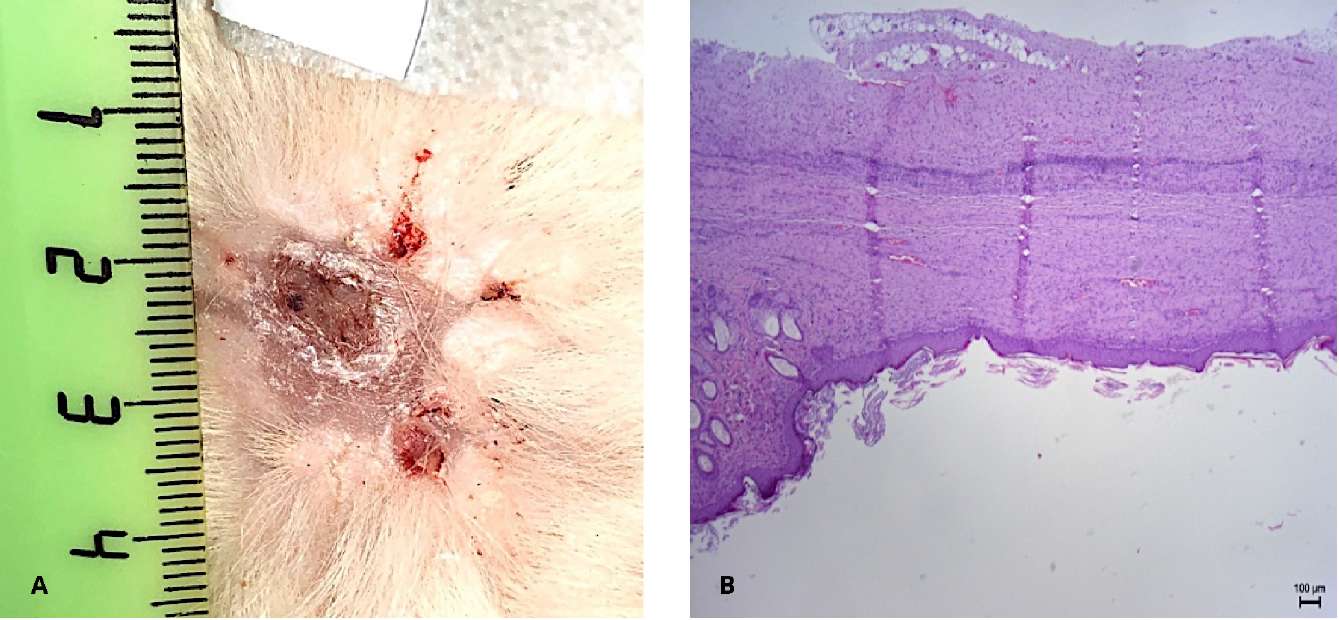
Рисунок 9. 45-е сутки наблюдения:
А — эпителиальная площадка, покрытая эпителием полости рта;
В — многослойный плоский неороговевающий эпителий полости рта, окраска
(гематоксилин-эозин, ув. ×100)
Figure 9. Follow-up day 45: А — wound epithelialization by oral mucosa.
В — non-keratinized stratified squamous epithelium (hematoxylin-eosin, magn. ×100)
Результаты клинической части исследования получены при динамическом наблюдении за пациентами после первого и второго этапов операции. К 4 – 6-му месяцу у всех мужчин сформировалась уретральная площадка без выраженных рубцовых изменений (рис. 10). По данным гистологического заключения определяется многослойный плоский неороговевающий эпителий с явлениями гиперпаракератоза и сформированной собственной пластинкой.
Всем пациентам выполнена тубуляризация уретры. У двоих пациентов в связи с трудностями мобилизации краёв площадки для тубуляризации использовали дополнительный трансплантат слизистой полости рта шириной 1 см, фиксированный к краям площадки вентрально. Дополнительно линия швов укрыта лоскутом tunica dartos.
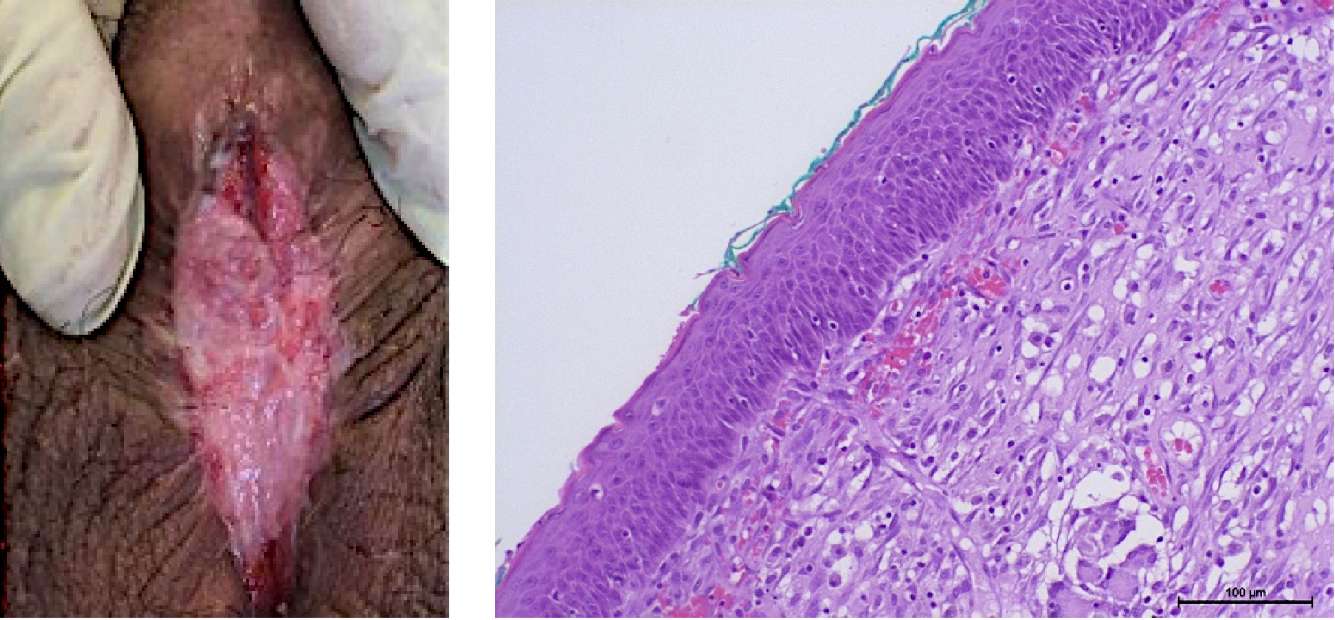
Рисунок 10. 6 месяцев после первого этапа уретропластики:
А — уретральная площадка;
В — многослойный плоский неороговевающий эпителий полости рта
(гематоксилин-эозин, ув. ×200)
Figure 10. Six months after the stage 1 of urethroplasty: А — urethral plate;
В — non-keratinized stratified squamous epithelium (hematoxylin-eosin, magn. ×200)
После удаления катетера (через 21 день после операции) у всех мужчин восстановилось самостоятельное мочеиспускание удовлетворительной струей. Максимальная скорость мочеиспускания составила 22,7 ± 4,2 мл/с (через 9 месяцев после операции, n = 3) и далее на протяжении всего срока наблюдения существенно не изменялась. Средний объём остаточной мочи после операции составил 34,8 ± 2,2 мл, при дальнейшем наблюдении этот показатель варьировал в пределах от 26,5 ± 5,3 мл до 43,8 ± 4,2 мл (p > 0,05 между точками). У всех больных по данным уретрографии сохраняется адекватный просвет уретры (рис. 11).
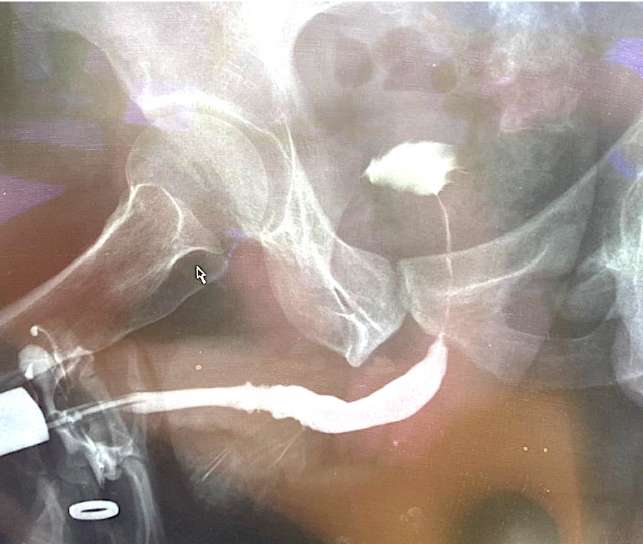
Рисунок 11. Восходящая уретрограмма через 6 месяцев после тубуляризации неоуретры
Figure 11. Retrograde urethrography 6 months after neourethra tubularization
При анализе результатов анкетирования мужчин опросником PROM-USS через 6 месяцев после оперативного лечения суммарный балл оценки симптомов составил 7,4 ± 1,2. При оценке качества жизни опросником EQ-5D выявлено значительное увеличение данных показателей с 0,64 ± 0,0 до 0,79 ± 0,2 (p < 0,05). Все пациенты отметили высокую удовлетворённость результатами лечения.
Обсуждение
Проблема дефицита пластического материала не нова для реконструктивных хирургов различных специальностей. Одним из решений данной проблемы является использование микрографтов, применение которых значительно снижает потребность в донорском материале и сокращает сроки эпителизации раны [17]. В реконструктивной урологии опубликован ряд экспериментальных исследований с использованием микрографтов (слизистая мочевого пузыря, кожа и слизистая полости рта) для восстановления нижних мочевых путей [25][26][27][28]. Несмотря на то, что переходноклеточный эпителий мочевого пузыря является родственным эпителию уретры, получение трансплантатов мочевого пузыря сопряжено со значительной морбидностью. В то же время в реконструктивной урологии давно и с большим успехом используют трансплантаты слизистой полости рта ввиду хорошей доступности и относительно низкой морбидности забора [5][8][30]. В нашей работе по этим причинам мы также предпочли использовать микрографты слизистой полости рта. Учитывая малые размеры, фиксацию их к ложу осуществляли с использованием фибрин-тромбинового хирургического клея.
В данном исследовании впервые показана возможность формирования из микрографтов эпителиальной площадки, выстланной эпителием слизистой полости рта, превышающей в 3 – 4 раза площадь использованной для этого ткани. Применение раневой камеры позволило существенно сократить влияние контракции раны (особенно в первые две недели после трансплантации) и в последующем использовать экспериментальные результаты при разработке новой технологии лечения пациентов с протяженными стриктурами уретры. В клинической части исследования приведены четыре первых в клинической практике случая применения микрографтов слизистой полости рта с фибрин-тромбиновым клеем для формирования уретральной площадки при многоэтапном лечении таких больных. В этой пилотной серии получены весьма обнадёживающие результаты. К 6-му месяцу формируется зрелая уретральная площадка без выраженных рубцовых деформаций и необходимых размеров, достаточных для последующей тубуляризации неоуретры. В настоящее время ещё рано говорить об эффективности представленной методики ввиду малой выборки пациентов и коротких сроков наблюдения. Среди возможных её преимуществ необходимо отметить бережливое использование слизистой полости рта при реконструктивных операциях на уретре, сокращение количества этапов лечения в связи отсутствием выраженной рубцовой деформации эпителиальной площадки и неоуретры. Всё это должно привести к большей удовлетворенности пациента и врача результатами лечения.
В настоящее время активно разрабатываются различные тканеинженерные конструкции для замещения рубцовоизмененной уретры. Как правило, все они состоят из той или иной матрицы и кератиноцитов, наработанных из первичной культуры клеток эпителия полости рта пациента in vitro (сами по себе или в виде эпителиальных сфероидов) [31]. Предлагаемая технология с использованием микрографтов по своей сути является аналогом такой тканеинженерной конструкции, созданной без применения клеточных технологий, а значит и без присущих им недостатков (дороговизна реактивов и оборудования для культивирования in vitro, законодательное ограничение клинического применения и т.д.).
Таким образом, новый подход к применению слизистой полости рта в реконструктивной хирургии уретры с использованием микрографтов является перспективным для клинического изучения, отличается относительной простотой и возможностью осуществления в условиях стандартной операционной.
Заключение
По данным экспериментального этапа исследований микрографты слизистой полости рта, адекватно приживаются при гетеротопической трансплантации в условиях влажной раны (в 72,7%). К 21-му дню после трансплантации они способны создать единый эпителиальной пласт на поверхности раны, по площади превышающий в 3–4 раза суммарную площадь микрографтов. Однако базальная пластинка эпителия к этому времени ещё не сформирована, что теоретически ограничивает возможность тубуляризации на этих сроках.
Первый клинический опыт использования микрографтов слизистой полости рта показывает возможности применения данной технологии в реконструктивной хирургии уретры, особенно при «сложных» стриктурах уретры и при дефиците пластического материала. Наши результаты показывают, что у двух больных из четырёх, вошедших в исследование, эта методика позволила сформировать уретральную площадку необходимых размеров без выраженных рубцовых деформаций, достаточную для последующего формирования уретры. При этом возможно использовать значительно меньшие по общей площади трансплантаты слизистой полости рта. Окончательные выводы об эффективности данного подхода делать рано. Предстоит оценить его на достаточном материале, при длительных сроках наблюдения и в различных клинических ситуациях.
Список литературы
1. Коган М.И., Красулин В.В., Митусов В.В., Шангичев В.А., Аметов Р.Э., Наранов С.В. Эффективность хирургического лечения протяженных и субтотальных стриктур уретры у мужчин. Медицинский вестник Башкортостана. 2013;8(2):95-97. eLIBRARY ID: 20170231.
2. Котов С.В. Результаты многоэтапной (заместительной) уретропластики. Экспериментальная и клиническая урология. 2015;(4):60-6. eLIBRARY ID: 25659705.
3. Kulkarni S, Kulkarni J, Surana S, Joshi PM. Management of Panurethral Stricture. Urol Clin North Am. 2017;44(1):67-75. DOI: 10.1016/j.ucl.2016.08.011. Erratum in: Urol Clin North Am. 2017;44(2):xix. PMID: 27908373.
4. Dubey D, Vijjan V, Kapoor R, Srivastava A, Mandhani A, Kumar A, Ansari MS. Dorsal onlay buccal mucosa versus penile skin flap urethroplasty for anterior urethral strictures: results from a randomized prospective trial. J Urol. 2007;178(6):2466-9. DOI: 10.1016/j.juro.2007.08.010.
5. Barbagli G, Fabri F, Romano G, Michele D, Lazerri M. Evaluation of early, late complications and patient satisfaction in 300 patients who underwent oral graft harvesting from a single cheek using a standardised technique in a referral center experience. J Urol suppl. 2009;181:14. DOI: 10.1016/S0022-5347(09)60052-5.
6. Wessells H, Angermeier K W, Elliott S, Gonzalez CM, Kodama R, Peterson AC, Reston J, Rourke K, Stoffel JT, Vanni AJ, Voelzke BB, Zhao L, Santucci RA. Male urethral stricture: American urological association guideline. J Urol. 2017;197(1):182-190. DOI: 10.1016/j.juro.2016.07.087.
7. El-Kasaby AW, Fath-Alla M, Noweir AM, el-Halaby MR, Zakaria W, el-Beialy MH. The use of buccal mucosa patch graft in the management of anterior urethral strictures. J Urol. 1993;149:276-278. DOI: 10.1016/s0022-5347(17)36054-8.
8. Chapple C, Andrich D, Atala A, Barbagli G, Cavalcanti A, Kulkarni S, Mangera A, Nakajima Y. SIU/ICUD Consultation on Urethral Strictures: The management of anterior urethral stricture disease using substitution urethroplasty. Urology. 2014;83(3 Suppl):S31-47. DOI: 10.1016/j.urology.2013.09.012.
9. Barbagli G, De Angelis M, Palminteri E, Lazzeri M. Failed hypospadias repair presenting in adults. Eur Urol. 2006;49:887-894. DOI: 10.1016/j.eururo.2006.01.027.
10. Joshi, P M, Barbagli G, Batra V, Surana S, Hamouda A, Sansalone S, Costi D, Lazzeri M, Hunter C, Desai D J, Castiglone F, Kulkarni S B. A novel composite two-stage urethroplasty for complex penile strictures: A multicenter experience. Indian J Urol. 2017;33(2):155-158. DOI: 10.4103/0970-1591.203426.
11. Kozinn SI, Harty NJ, Zinman L, Buckley JC. Management of complex anterior urethral strictures with multistage buccal mucosa graft reconstruction. Urology. 2013;82(3):718-22. DOI: 10.1016/j.urology.2013.03.081.
12. Andrich DE , Greenwell TJ, Mundy AR. The problems of penile urethroplasty with particular reference to 2-stage reconstructions. J Urol. 2003;170(1):87-9. DOI: 10.1097/01.ju.0000069721.20193.fd.
13. Myers JB, McAninch JW, Erickson BA, Breyer BN. Treatment of adults with complications from previous hypospadias surgery. J Urol. 2012;188 (2):459-463. DOI: 10.1016/j.juro.2012.04.007.
14. Rashidbenam Z, Jasman MH, Hafez P, Tan GH, Goh EH, Fam XI, Kong Ho CC, Zainuddin Z, Rajan R, Nor FM, Shuhaili MA, Kosai NR, Imran F H, Ng MH. Overview of Urethral Reconstruction by Tissue Engineering: Current Strategies, Clinical Status and Future Direction. Tissue Eng Regen Med. 2019;16(4):365-384. DOI: 10.1007/s13770-019-00193-z.
15. Osman NI, Hillary C, Bullock AJ, MacNeil S, Chapple CR. Tissue engineered buccal mucosa for urethroplasty: progress and future directions. Adv Drug Deliv Rev. 2015;82-83:69-76. DOI: 10.1016/j.addr.2014.10.006.
16. Федеральный закон от 23 июня 2016 г. N 180-ФЗ "О биомедицинских клеточных продуктах" (с изменениями и дополнениями). Ссылка активна на 26.02.2022. https://base.garant.ru/71427992/
17. Meek CP. Successful microdermagrafting using the Meek-Wall microdermatome. Am J Surg. 1958;96:557-558. DOI: 10.1016/0002-9610(58)90975-9.
18. Hu G, Zhang P, Chen Y, Yuan Z, Song H. Efficacy of two-stage Meek micrografting in patients with severe burns. J Burn Care Res. 2021;irab241. DOI: 10.1093/jbcr/irab241.
19. Hackl F, Bergmann J, S. Granter S, Koyama T, Kiwanuka E, Zuhaili B, Pomahac B, Caterson E J, Junker J, Eriksson E. Epidermal Regeneration by Micrograft Transplantation with Immediate 100-Fold Expansion. Plastic and Reconstructive Surgery. 2012;129(3):443e-452e. DOI: 10.1097/PRS.0b013e318241289c.
20. Wang CH, Lin YJ, Hu S, Huang YL, Chung WH, Ng CY. Efficacy and safety of automated epidermal micrograft in patients with stable segmental and nonsegmental vitiligo. J Cosmet Dermatol. 2021. DOI: 10.1111/jocd.14548.
21. Pothula SR, Jayanth BS. Hair Transplantation. Oral and Maxillofacial Surgery for the Clinician. 2021:707-730. DOI: 10.1007/978-981-15-1346-6_34.
22. Marcarelli M, Zappia M, Rissolio L, Baroni C, Astarita C, Trovato L, Graziano A. Cartilage Micrografts as a Novel Non-Invasive and Non-Arthroscopic Autograft Procedure for Knee Chondropathy: Three-Year Follow-Up Study. J Clin Med. 2021;10(2):322. DOI: 10.3390/jcm10020322.
23. Jimi S, Takagi S, De Francesco F, Miyazaki M, Saparov A. Acceleration of Skin Wound-Healing Reactions by Autologous Micrograft Tissue Suspension. Medicina (Kaunas). 2020;56(7):321. DOI: 10.3390/medicina56070321.
24. Miranda R, Farina E, Farina MA. Micrografting chronic lower extremity ulcers with mechanically disaggregated skin using a micrograft preparation system. J Wound Care. 2018;27(2):60-65. DOI: 10.12968/jowc.2018.27.2.60.
25. Ajalloueian F, Zeiai S, Rojas R, Fossum M, Hilborn J. One-stage tissue engineering of bladder wall patches for an easy-to-use approach at the surgical table. Tissue Eng Part C Methods. 2013;19(9):688-96. DOI: 10.1089/ten.TEC.2012.0633.
26. Nikolavsky D, Manwaring J, Bratslavsky G, Caza T, Landas S, Hryniewicz-Jankowska A, Kotula L. Novel Concept and Method of Endoscopic Urethral Stricture Treatment Using Liquid Buccal Mucosal Graft. J Urol. 2016;196(6):1788-1795. DOI: 10.1016/j.juro.2016.05.028.
27. Engberg GR, Chamorro CI, Nordenskjöld A, Fossum M. Expansion of Submucosal Bladder Wall Tissue In Vitro and In Vivo. Biomed Res Int. 2016;2016:5415012. DOI: 10.1155/2016/5415012.
28. Chamorro CI, Zeiai S, Reinfeldt Engberg G, Fossum M. Minced Tissue in Compressed Collagen: A Cell-containing Biotransplant for Single-staged Reconstructive Repair. J Vis Exp. 2016;(108):53061. DOI: 10.3791/53061.
29. Nuutila K, Singh M, Kruse C, Philip J, Caterson EJ, Eriksson E. Titanium wound chambers for wound healing research. Wound Repair Regen. 2016;24(6):1097-1102. DOI: 10.1111/wrr.12472.
30. Lumen N, Campos-Juanatey F, Greenwell T, Martins FE, Osman NI, Riechardt S, Waterloos M, Barratt R, Chan G, Esperto F, Ploumidis A, Verla W, Dimitropoulos K. European Association of Urology Guidelines on Urethral Stricture Disease (Part 1): Management of Male Urethral Stricture Disease. Eur Urol. 2021;80(2):190-200. DOI: 10.1016/j.eururo.2021.05.022.
31. Zurina IM, Shpichka AI, Saburina IN, Kosheleva NV, Gorkun AA, Grebenik EA, Kuznetsova DS, Zhang D, Rochev YA, Butnaru DV, Zharikova TM, Istranova EV, Zhang Y, Istranov LP, Timashev PS. 2D/3D buccal epithelial cell self-assembling as a tool for cell phenotype maintenance and fabrication of multilayered epithelial linings in vitro. Biomed Mater. 2018;13(5):054104. DOI: 10.1088/1748-605X/aace1c.
Об авторах
А. Н. ШибаевРоссия
Андрей Николаевич Шибаев — кандидат медицинских наук; ведущий научный сотрудник урологического отделения
г. Москва
Ю. В. Павлова
Россия
Юлия Викторовна Павлова — кандидат медицинских наук; научный сотрудник урологического отделения
г. Москва
В. В. Базаев
Россия
Владимир Викторович Базаев — доктор медицинских наук, профессор; ведущий научный сотрудник урологического отделения
г. Москва
А. А. Подойницын
Россия
Алексей Алексеевич Подойницын — доктор медицинских наук; руководитель урологического отделения
г. Москва
Д. И. Султанов
Россия
Дмитрий Ибрагимович Султанов — ординатор кафедры урологии
г. Москва
А. Д. Шинкарев
Россия
Артём Дмитриевич Шинкарёв — курсант
г. Санкт-Петербург
Р. С. Сулейманов
Россия
Руслан Сулейманович Сулейманов — врач-уролог хирургического отделения университетской клиники
г. Тверь
Рецензия
Для цитирования:
Шибаев А.Н., Павлова Ю.В., Базаев В.В., Подойницын А.А., Султанов Д.И., Шинкарев А.Д., Сулейманов Р.С. Новый подход к применению слизистой полости рта в реконструктивной хирургии уретры: микрографты. Вестник урологии. 2022;10(1):70-83. https://doi.org/10.21886/2308-6424-2022-10-1-70-83
For citation:
Shibaev A.N., Pavlova Yu.V., Bazaev V.V., Podoinitsyn A.A., Sultanov D.I., Shinkarev A.D., Suleimanov R.S. A new approach to use of oral mucosa in reconstructive urethral surgery: micrografts. Urology Herald. 2022;10(1):70-83. (In Russ.) https://doi.org/10.21886/2308-6424-2022-10-1-70-83








-1-8-1_page-0001.jpg)






































