Научно-практический рецензируемый ежеквартальный сетевой журнал «Вестник урологии» («Vestnik Urologii / Urology Herald») издаётся Ростовским государственным медицинским университетом. Первый выпуск опубликован 31 мая 2013 года.
Решением Высшей аттестационной комиссии при Министерстве науки и высшего образования Российской Федерации от 17.12.2019 года журнал включён в ПЕРЕЧЕНЬ рецензируемых научных изданий, в которых должны быть опубликованы основные научные результаты диссертаций на соискание учёной степени кандидата наук, на соискание учёной степени доктора наук. Научная специальность и соответствующая ей отрасль науки, по которой присуждаются ученые степени: 3.1.13 — Урология и андрология (медицинские науки)
22 ноября 2022 года журнал одобрен Консультативным советом по отбору контента Scopus (CSAB) для включения в международную базу данных SCOPUS.
Главный редактор: д-р. мед. наук, проф. Глухов Владимир Павлович (Ростов-на-Дону, Россия)
Первый заместитель главного редактора: д-р мед. наук, проф. Коган Михаил Иосифович (Ростов-на-Дону, Россия)
Заместитель главного редактора: канд. мед. наук Ильяш Анна Владимировна (Ростов-на-Дону, Россия)
Ответственный редактор: канд. мед. наук Исмаилов Руслан Самедович (Ростов-на-Дону, Россия)
Редакционная коллегия / редакционный совет: ведущие специалисты России, Европы, Азии и США
Тип рецензирования: двустороннее слепое (анонимное)
Научная тематика: общая урология, андрология, онкоурология, уроинфекциология, нейроурология, детская урология, женская урология, визуализация в урологии, эндоскопическая и лапароскопическая урология, реконструктивно-пластическая урология, трансплантология, анестезиология в урологии, урологическое образование, история урологии
Контент: оригинальные статьи, дискуссионные статьи, обзоры литературы, клинические наблюдения, лекции, история урологии, клинические рекомендации, новые медицинские технологии в урологии, отчёты о научно-образовательных мероприятиях
Читательская аудитория: урологи, андрологи, онкоурологи, детские урологи-андрологи, нефрологи, гинекологи, хирурги, трансплантологи, анестезиологи, врачи общей практики, научные сотрудники, специалисты фармакологических компаний
В своей работе редакция журнала «Вестник урологии» руководствуется правилами и рекомендациями:
- Комитета по этике научных публикаций (COPE)
- Всемирной ассоциации медицинских редакторов (WAME)
- Международного комитета редакторов медицинских журналов (ICMJE)
- Едиными стандартами представления результатов испытаний (CONSORT)
- Рекомендациями в отношении принципов, которые должны лежать в основе заявлений об издательской этике и недобросовестной издательской практике (PEMS)
Форма периодического распространения: сетевая
Тип доступа: открытый
Частота публикаций: ежеквартальная (4 выпуска в год); с 2024 года - 6 выпусков в год
Первый номер: 31 мая 2013
Языки: русский, английский
Территория распространения: Российская Федерация, зарубежные страны
Учредитель: федеральное государственное бюджетное образовательное учреждение высшего образования «Ростовский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Поддержка: выпуск журнала осуществляется при поддержке профессиональной некоммерческой организации "Ассоциация Урологов Дона"
Адрес редакции: 344022, Россия, г. Ростов-на-Дону, пер. Нахичеванский, 29
E-mail редакции: urovest@mail.ru
Телефон редакции: +7 (863) 201-44-48
Свидетельство о регистрации средства массовой информации: Эл № ФС77-53256 от 22 марта 2013 года выдано Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций (Роскомнадзор)
ISSN: 2308-6424
Текущий выпуск
ОРИГИНАЛЬНЫЕ СТАТЬИ
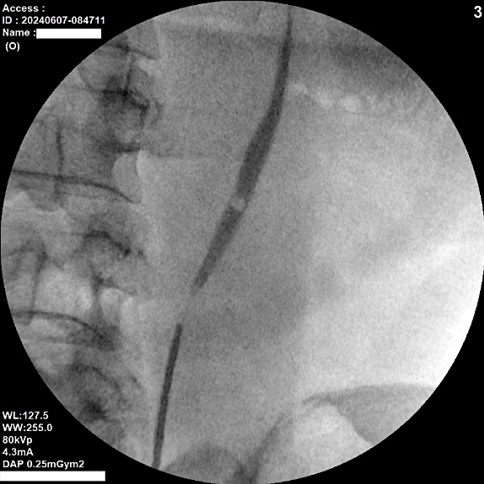
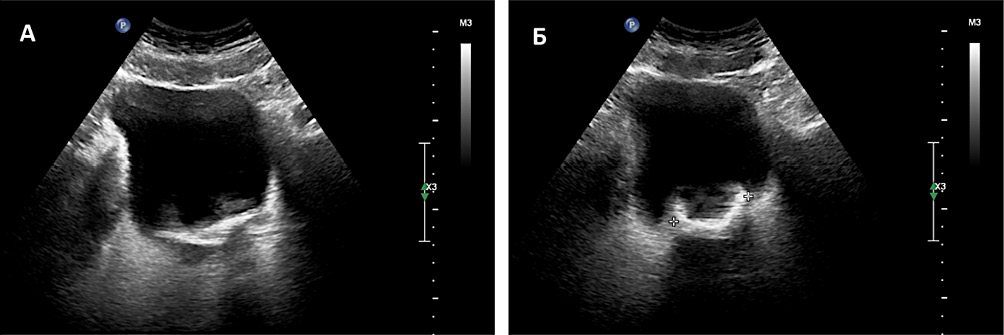
Введение. Золотым стандартом оперативного лечения пациентов с камнями почек больше 2 см является перкутанная нефролитотомия (ПНЛ), первый этап которой заключается в проведении торцевого катетера в верхние мочевые пути с целью контрастирования чашечно-лоханочной системы (ЧЛС). Одной из модификаций классической методики ПНЛ является директивная пункция, когда пункция ЧЛС проводится напрямую с помощью ультразвуковой или рентгеноскопической навигации без предварительного контрастирования ЧЛС.
Цель исследования. Сравнить эффективность и безопасность традиционной методики ПНЛ (мини-ПНЛ / мПНЛ) с установкой мочеточникового катетера и ПНЛ с применением директивной пункции (дПНЛ).
Материалы и методы. Проанализированы результаты лечения 67 пациентов, которым с сентября 2021 года по март 2023 года была выполнена перкутанная нефролитотомия. В группе 1 использовали традиционную методику ПНЛ (n = 35), в группе 2 — директивную пункцию (n = 32). Оценивали длительность операции, длительность пункций, качество визуализации ЧЛС, кровопотерю (падение гемоглобина после операции), почечную функцию (изменение креатинина после операции) и постоперационные осложнения по шкале Clavien-Dindo. Для оценки частоты избавления (SFR) от камней пациентам проводили компьютерную томографию (КТ) органов брюшной полости в первые сутки после операции.
Результаты. Длительность операции была меньше в среднем на 16 минут в группе 2 (p < 0,001) за счёт отсутствия первого этапа. Время пункции в группах не различалось (p = 0,739), при этом средняя продолжительность пункции составила 2 минуты. Частота избавления пациентов от камней (SFR) в группах не различалась — 91,4% (мПНЛ) против 93,8% (дПНЛ) (p > 0,999). Падение гемоглобина и изменение креатинина было сопоставимо в обеих группах (p = 0,320 и p = 0,442 соответственно). Ни одному пациенту не потребовалось переливание крови. Осложнения III и IV класса по Clavien-Dindo не встречались.
Заключение. Пункция без предварительного этапа дренирования ЧЛС безопасна и эффективна по сравнению с традиционной методикой и даёт преимущество по времени оперативного вмешательства.
Ведение. Дифференциальная диагностика гиперплазии предстательной железы (ГПЖ) и рака предстательной железы (РПЖ) является сложным многоступенчатым процессом. При этом известно, что мужчины с ГПЖ и РПЖ имеют достоверные различия в особенностях сексуальной активности на протяжении жизни.
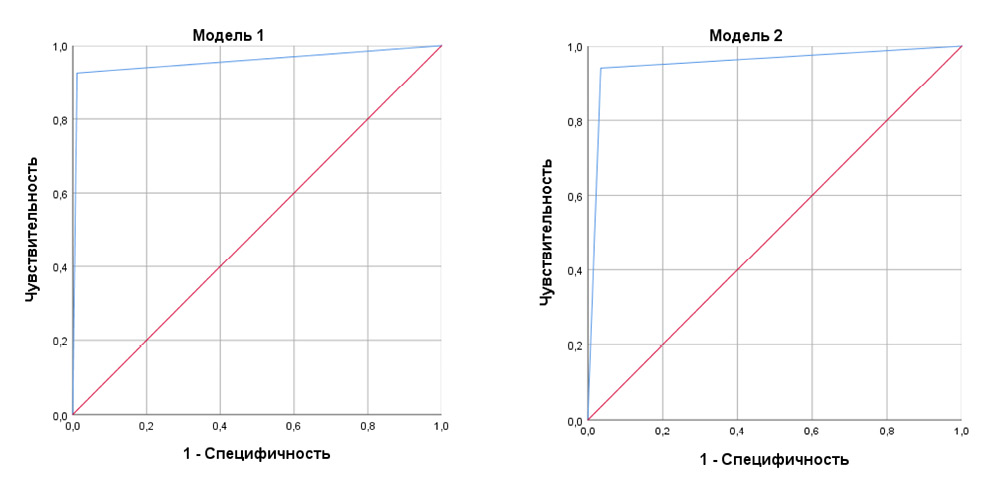
Цель исследования. Разработать модель прогнозирования рисков РПЖ или ГПЖ с учётом сексуальной активности мужчин и создать на этой основе калькулятор дифференциации РПЖ и ГПЖ.
Материалы и методы. В открытое проспективное кросс-секциональное несравнительное исследование включены 47 мужчин в возрасте 49 – 71 года с ГПЖ и 87 мужчин в возрасте 47 – 70 лет с впервые установленным диагнозом «РПЖ». У пациентов определяли уровень ПСА сыворотки крови, общего тестостерона, объём предстательной железы. Оценивали результаты опроса по результатам анкеты «Ростовский опросник интегральной оценки мужской сексуальности».
Результаты. Методики логистической регрессии позволили установить, что прогнозирование ГПЖ или РПЖ возможно на основании уровня сексуальности пациента, объёма предстательной железы и уровня ПСА. При увеличении уровня сексуальности на 1 балл шансы на то, что у пациента будет диагноз «ГПЖ», а не «РПЖ», возрастают в среднем в 1,08 раза. При увеличении объёма ПЖ на 1 см3 шансы выявления ГПЖ возрастают в среднем в 1,15 раза. При увеличении уровня ПСА на 1 нг/мл шансы на ГПЖ по сравнению с РПЖ снижаются в 0,13 раза. На основании результатов математического моделирования разработан калькулятор дифференциации.
Заключение. Простой калькулятор, представленный в исследовании, имеет чувствительность и специфичность > 0,90 и может быть оценён в предстоящих клинических испытаниях.
Введение. На сегодняшний день развитие реконструктивной урологии демонстрирует высокие показатели эффективности лечения стриктур уретры, обеспечивая удовлетворительные параметры мочеиспускания. При этом существует потребность в поддержании высокого качества жизни, связанного с сексуальной функцией мужчин.
Цель исследования. Оценить эректильную функцию мужчин со стриктурной болезнью уретры в зависимости от наличия факторов риска эректильной дисфункции (ЭД), характеристик стриктур и применяемых методик хирургии.
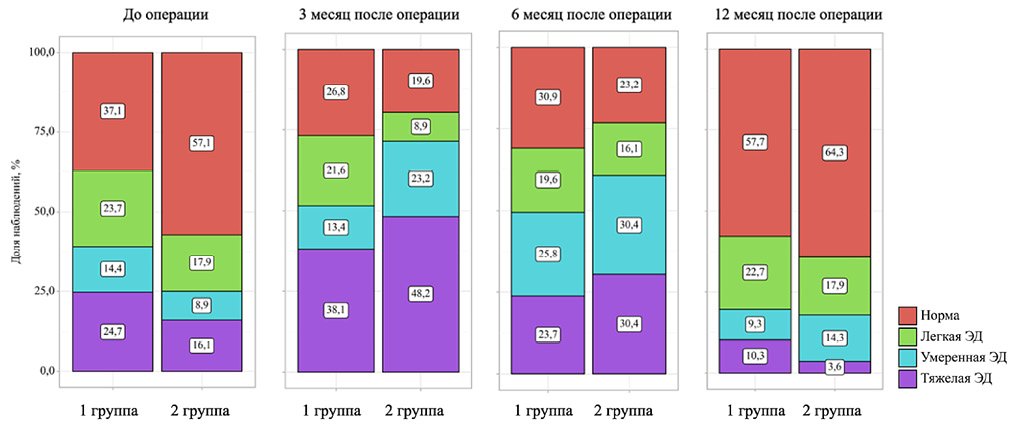
Материалы и методы. В исследование включены 153 сексуально активных пациента со стриктурами уретры, подвергнутых хирургическому лечению. Оценку эректильной функции проводили с помощью использования опросника МИЭФ-5, при этом учитывали наличие у пациентов факторов риска развития ЭД (возраст, курение, ишемическая болезнь сердца, артериальная гипертензия, сахарный диабет), параметры стриктур (первичная / рецидивная, протяжённость) и технику хирургии (с пересечением и без пересечения спонгиозного тела). Контрольные точки оценки: исходно (до хирургии), через 3, 6, и 12 месяцев после уретропластики.
Результаты. Медиана возраста пациентов составила 53,0 года, показателей эректильной функции до операции — 19,0 балла. Вне зависимости от изучаемых параметров во всех группах исследования к 3-му месяцу наблюдения отмечено ухудшение показателей эректильной функции, которое регрессировало к году наблюдения. Длительность восстановления и тяжесть нарушения эректильной функции была связана с возрастом, курением, наличием ишемической болезни сердца и артериальной гипертензии, протяжённостью стриктуры и рецидивным характером стриктур. Значимых различий в показателях эректильной функции после оперативного вмешательства, в зависимости от степени пересечения спонгиозного тела, не выявлено. По результатам многофакторного анализа предикторами развития ЭД после операции являются возраст (СОШ 1,082; 95% ДИ 1,038 – 1,127; p < 0,001), артериальная гипертензия (СОШ 4,608; 95% ДИ 1,089 –19,511; p = 0,038) и исходный статус эректильной функции (СОШ 0,046; 95% ДИ 0,013 – 0,160; p < 0,001).
Заключение. Нарушения эректильной функции после хирургического лечения стриктур уретры имеют преимущественно транзиторный характер с регрессией к 12-му месяцу наблюдения. Негативное влияние на восстановление эректильной функции оказывают пожилой возраст, курение, сердечно-сосудистые заболевания, протяжённость и рецидивный характер стриктур.
Введение. Инфекции мочевых путей (ИМП) часто встречаются у детей, особенно при анатомических аномалиях, таких как пузырно-мочеточниковый рефлюкс (ПМР). Диагностика ПМР обычно следует за эпизодом ИМП, что подчёркивает важность раннего выявления ПМР при ИМП для предотвращения почечных осложнений. Вопрос тактики ведения первой фебрильной ИМП остаётся спорным: педиатры рекомендуют диагностику после повторных ИМП, тогда как урологи настаивают на ранней визуализации и профилактике. Антибиотикопрофилактика (АБП) перед операцией помогает снизить риск рецидивов ИМП, но вызывает резистентность и изменяет микробиоту.
Цель исследования. Оценить микробиоту мочепузырной мочи у детей перед операцией по поводу ПМР.
Материалы и методы. В исследование включены 40 детей (12 мальчиков — группа 1, 28 девочек —группа 2), у которых ПМР выявлен после манифестной инфекции мочевых путей. Контрольные группы — 18 здоровых мальчиков (группа 3) и 16 здоровых девочек (группа 4). Сбор мочи и её культуральное исследование осуществляли с использованием расширенного набора питательных сред (10 – 12) для культивирования аэробных и анаэробных таксонов микробиоты.
Результаты. Медианный возраст пациентов с ПМР в исследуемых группах 3,6 года, причём среди них было больше девочек (p < 0,001). Моча детей с ПМР была нестерильной, в ней были обнаружены 27 таксонов микроорганизмов, из которых 16 — аэробы и 11 — анаэробы. Доминирующие таксоны различались по группам: у мальчиков с ПМР преобладали Enterobacterales, Peptococcus spp. и Anaerococcus spp., у девочек с ПМР — коагулазонегативные стафилококки, Corynebacterium spp. и Peptococcus spp. Большинство микроорганизмов обнаруживалось в ассоциациях. Медиана уровня бактериурии в основном составила 10² КОЕ/мл. В целом у здоровых детей и у пациентов с ПМР выявлено 29 таксонов микробиоты с доминированием аэробноанаэробных взаимосвязей. У пациентов с ПМР достоверных корреляционных связей между различными таксонами микробиоты мочи было больше, чем у здоровых детей.
Заключение. Мочепузырная моча у детей с ПМР содержит аэробные и анаэробные бактерии. Повышают ли ассоциации бактерий при бактериурии 10² КОЕ/мл риск ИМП при хирургии ПМР, ещё предстоит выяснить, однако дисбиоз мочепузырной мочи следует исследовать как возможный фактор риска ИМП. Необходимы дальнейшие исследования для обоснования целесообразности и подбора селективной АБП в лечении ПМР.
Введение. Несмотря на дифференцированный отбор пациентов и усовершенствование хирургической техники радикальной простатэктомии (РПЭ), частота развития эректильной дисфункции (ЭД) довольно высока. Эффективность использования ингибиторов фосфодиэстеразы 5 типа (иФДЭ-5) у пациентов после нервосберегающей РПЭ может варьироваться от 35 до 75%. При этом одним из вопросов пенильной реабилитации после РПЭ является её продолжительность. Длительность приёма иФДЭ-5 в настоящее время не регламентирована, данные авторов разнятся и являются противоречивыми и недостаточными для того, чтобы рекомендовать определённые сроки пенильной реабилитации. Таким образом, необходимы дальнейшие исследования для определения целесообразной длительности реабилитации с помощью иФДЭ-5.
Цель исследования. Сравнить эффективность длительного приёма иФДЭ-5 в восстановлении эректильной функции у пациентов, перенёсших нервосберегающую РПЭ, с коротким 3-месячным курсом в раннем послеоперационном периоде.
Материалы и методы. Выполнен проспективный анализ данных 81 пациента с локальным РПЖ, которым была выполнена лапароскопическая нервосберегающая РПЭ. В послеоперационном периоде пациенты были разделены методом простой рандомизации на две группы. Пациенты группы 1 в качестве медикаментозной пенильной реабилитации получали иФДЭ-5 в течение 11 месяцев, а пациенты группы 2 — на протяжении 3 месяцев.
Результаты. Степень нарушения эректильной функции через 3 и 12 месяцев после РПЭ в обеих группах была сопоставима. Длительный курс приёма иФДЭ-5 не показал преимуществ на годовом этапе исследования по выраженности ЭД в сравнении с 3-месячным курсом терапии. Такая же тенденция прослеживалась и по результатам ночного пенильного теста. Кроме развития необратимой ЭД, постепенное укорочение полового члена после операции может вызвать неспособность пациента к мочеиспусканию стоя и в результате вызвать серьёзные психологические проблемы. При оценке длины полового члена в обеих группах отмечена тенденция к укорочению её на годовом этапе исследования, что говорит о недостаточной эффективности как годового, так и 3-месячного курса реабилитации иФДЭ-5.
Заключение. Длительный приём иФДЭ-5 в сравнении с краткосрочным курсом реабилитации не продемонстрировал преимуществ в восстановлении эректильной функции через год после нервосберегающей РПЭ.
Введение. Симптомы нижних мочевыводящих путей (СНМП), сексуальные нарушения и психологические расстройства сосуществуют в жизни мужчин старшего возраста. Оценка распространённости аффективных расстройств и сексуальных дисфункций после оперативного лечения гиперплазии предстательной железы имеет важное значение для обеспечения высокого качества жизни пациентов наряду c СНМП.
Цель исследования. Провести анализ частоты встречаемости и тяжести аффективных расстройств у больных до и после лазерной энуклеации предстательной железы, а также оценить их связь с СНМП и эректильной функцией.
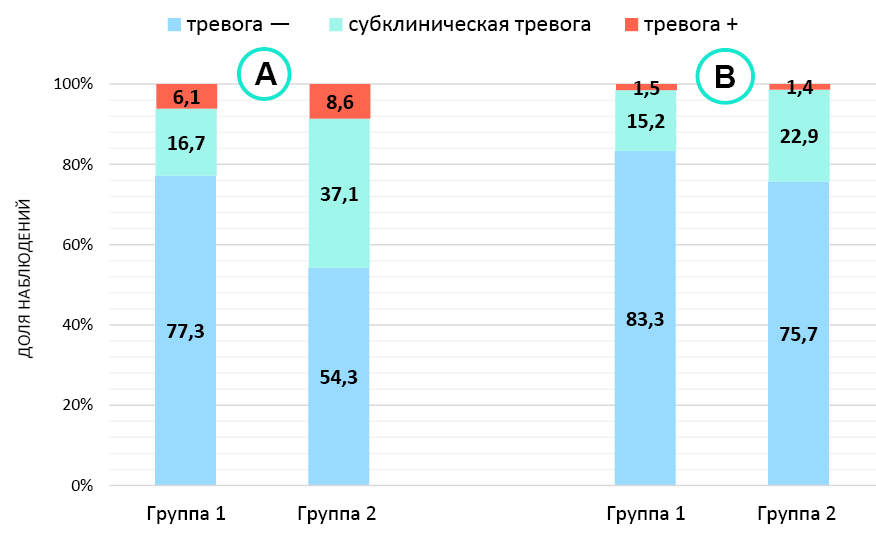
Материалы и методы. В исследование включены 136 пациентов с гиперплазией простаты, подвергшихся лазерной энуклеации в период 2018 – 2023 гг. Все мужчины вели половую жизнь, эректильная функция, по данным МИЭФ-5, составляла ≥ 11 баллов. Помимо прохождения стандартных методов обследования, все пациенты на предоперационном этапе и через 18 месяцев после хирургии заполняли опросники IPSS, МИЭФ-5 и HADS. На первом этапе исследования изучали распространённость и тяжесть аффективных расстройств до и после оперативного лечения, определяли их связь с СНМП, на втором этапе изучали связь аффективных расстройств с сексуальными нарушениями. Пациенты были разделены на две группы в зависимости от отсутствия или наличия негативного влияния СНМП на качество сексуальной жизни: группа 1 (n = 70) — влияния нет, группа 2 (n = 66) — влияние есть.
Результаты. Тревожные и депрессивные расстройства различной степени выраженности обнаружены у 48 (35,3%) и 46 (33,8%) пациентов соответственно. Установлено, что тяжесть как тревожных (r = 0,574; p < 0,001), так и депрессивных расстройств до оперативного лечения коррелировала с СНМП (r = 0,590; p < 0,001), однако после оперативного лечения только баллы тревожных расстройств имели корреляцию с СНМП (r = 0,742; p < 0,001), в частности, с симптомами накопления (r = 0,475; p < 0,001). Пациенты группы 2 имели более низкие баллы МИЭФ-5 (18,0 против 21,0 балла; p < 0,001) и чаще отмечали тревожно-депрессивные расстройства до оперативного лечения (45,7 и 44,3% против 22,8 и 22,7%; p < 0,05), при этом после хирургии у них наблюдалось значимое улучшение эректильной функции и аффективного статуса в отличие от пациентов группы 1, у которых баллы МИЭФ-5 и частота встречаемости аффективных расстройств значимо не менялись.
Заключение. Пациенты преимущественно с ирритативным профилем СНМП и негативным влиянием нарушенного мочеиспускания на сексуальную жизнь более склонны испытывать тревожно-депрессивные расстройства, поэтому при лечении мужчин с СНМП важно оценивать их аффективный статус с целью повышения качества их жизни.
Введение. Основным методом оперативного лечения мужчин со стрессовым недержанием мочи средней и тяжёлой степени является установка искусственного мочевого сфинктера (ИМС). Несмотря на эффективность, имплантация сопряжена с развитием осложнений, в ряде случаев требующих ревизий и удаления всего устройства или его компонентов.
Цель исследования. Оценить результаты установки ИМС в отношении безопасности и необходимости повторных вмешательств при длительном наблюдении.
Материалы и методы. С 2004 по 2023 годы ИМС имплантирован 62 пациентам со стрессовым недержанием мочи тяжёлой степени. Осложнения учитывались согласно модифицированной классификации хирургических осложнений Clavien-Dindo. Производился учёт ревизий, сопровождающихся заменой компонентов или всего ИМС при отсутствии признаков инфекции, и ревизий, сопровождающихся удалением компонентов и всего ИМС в случае инфекции.
Результаты. Средний возраст пациента на момент имплантации составил 67,4 ± 8 лет. При медиане времени наблюдения 73,5 [14,8 – 118,3] месяца у 22 (35,5%) пациентов отмечены осложнения, выполнены 33 ревизии. Медиана времени до осложнения, требующего замены ИМС или его компонентов, составила 60 [50 – 94] месяцев. Медиана времени до осложнения, требующего удаления ИМС или его компонентов, составила 31 [8 – 83] месяц. Выявлено статистически значимое влияние сахарного диабета на замену компонентов ИМС (ОШ 4,9, p < 0,05).
Заключение. Установка ИМС связана с развитием осложнений, требующих ревизии, доля их составляет около трети всех вмешательств на ИМС. Ревизии позволяют восстановить работу ИМС и улучшить качество жизни пациентов. С учётом несовершенства применения общехирургической классификации осложнений у мужчин, перенёсших оперативное лечение недержания мочи, требуется пересмотр учёта и классификации осложнений этого вида вмешательств.
Введение. Пролапс тазовых органов (ПТО) и стрессовое недержание мочи (СНМ) являются распространёнными урогинекологическими заболеваниями, которые наносят серьёзный ущерб психоэмоциональному состоянию пациенток и крайне негативно сказываются на их качестве жизни. Изучение медико-социального профиля пациенток с данными патологиями может способствовать выбору тактики лечения, обоснованному принятию решения о проведении хирургического вмешательства и сокращения периода с момента первой рекомендации врача о необходимости операции до срока её проведения.
Цель исследования. Изучить медико-социальный профиль пациенток с ПТО / СНМ, имеющих показания к реконструктивным операциям. Провести сравнительный анализ медико-социальных профилей пациенток с ПТО и СНМ. Определить факторы, которые оказывали влияние на сроки принятия пациентками решения о хирургическом лечении (период принятия решения, ППР).
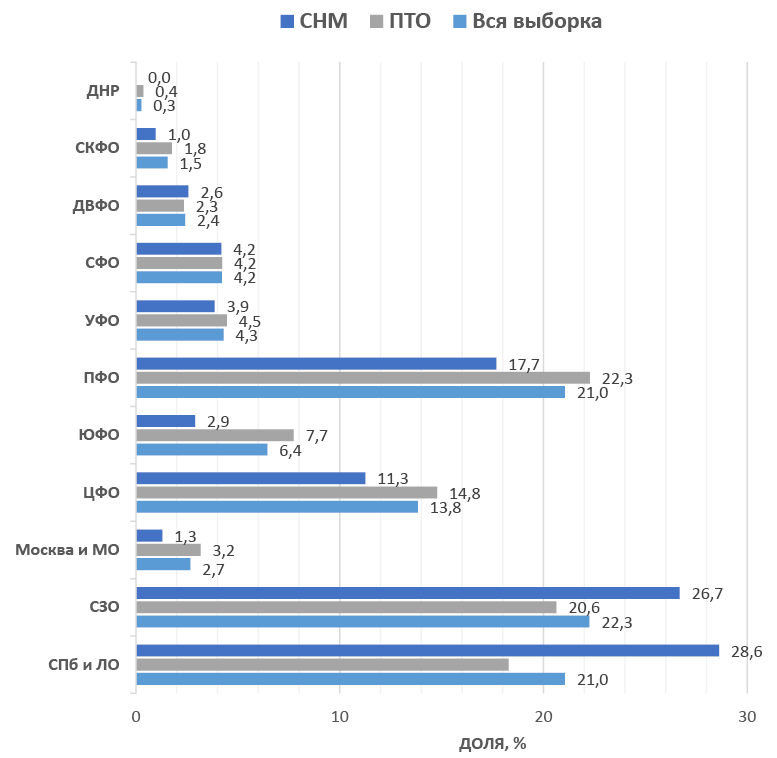
Материалы и методы. В настоящее одноцентровое проспективное исследование включены 1176 пациенток с ПТО (n = 860) или СНМ (n = 316), нуждающихся в проведении реконструктивных операций тазового дна. Все пациентки при поступлении в отделение заполняли специально разработанную для данного исследования анкету, которая включала социодемографическую информацию, информацию о предшествующем лечении, гинекологическом и акушерством анамнезе, регионе и месте проживания, трудовом статусе, финансовом положении, антропометрических показателях, уровне физической активности, занятиях спортом / гимнастикой, статусе курения, характере питания.
Результаты. Средний возраст пациенток составил 57,6 ± 11,7 года. При анализе полученных данных были обнаружены следующие различия между группами пациенток с ПТО и СНМ. Пациентки с ПТО старше, чем пациентки с СНМ (p < 0,001). В группе СНМ больше доля женщин с высшим образованием (p = 0,023), работающих пациенток (p < 0,001), не соблюдающих правильное питание и не занимающихся гимнастикой (p < 0,001), а также живущих половой жизнью (p < 0,001). Длительность жалоб, связанных с ПТО / СНМ, в среднем составила 6,7 ± 6,4 года. Данный период больше в группе с СНМ (p < 0,001). Длительность ППР о проведении операции в среднем составила 3 ± 5,3 года. ППР больше в группе с ПТО (p < 0,001). Различия в длительности ППР выявлены относительно уровня образования и трудовой занятости пациенток. У женщин с высшим образованием длительность ППР меньше (p = 0,018 для всей выборки; p = 0,008 для группы с ПТО). Длительность ППР больше у женщин, находящихся на пенсии, по сравнению с неработающими женщинами трудоспособного возраста (p = 0,028 для всей выборки; p = 0,026 для группы ПТО). У пациенток с 3 и 4 стадиями ПТО длительность ППР значимо больше, чем у женщин со 2 стадией ПТО (p = 0,007). У женщин с СНМ не выявлены различия между длительностью ППР и степенью недержания мочи на момент проведения операции (p > 0,05).
Заключение. В данном исследовании были продемонстрированы медико-социальные особенности пациенток, нуждающихся в реконструктивных операциях. Данные факторы необходимо учитывать для обоснованного принятия решения о хирургическом лечении.
КЛИНИЧЕСКИЕ НАБЛЮДЕНИЯ
Буккальная уретеропластика в настоящее время является операцией, всё чаще встречающейся в практике врача-уролога. Существуют различные методики выполнения этого хирургического пособия, которые требуют дальнейшего усовершенствования. В данной статье представлены клиническое наблюдение и ближайшие результаты уретеропластики с использованием слизистой ротовой полости по методике аугментационного анастомоза в собственной модификации у пациента 40 лет с протяжённой рецидивной стриктурой мочеточника с участком облитерации.
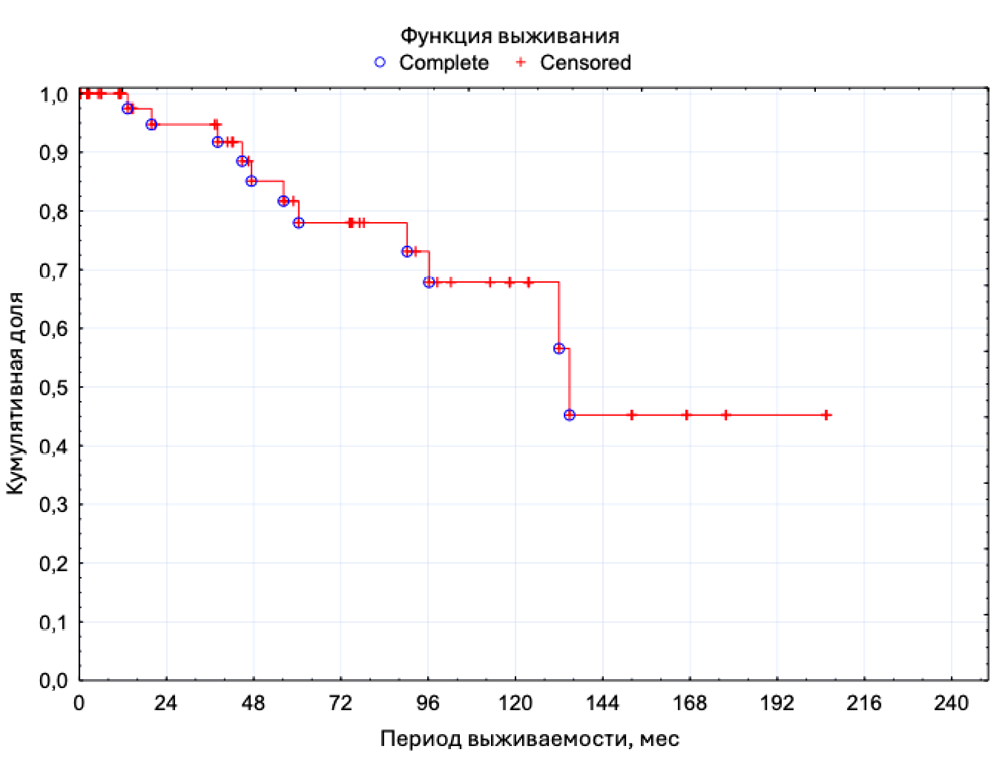
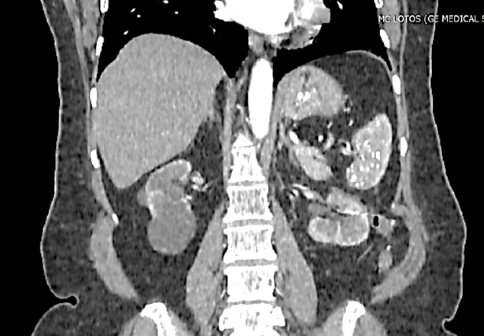
Основной метод лечения при клинически локализованном и местно-распространённом почечно-клеточном раке (ПКР) — хирургический. При выборе методики хирургического лечения отдаётся предпочтение органосохраняющему подходу — резекции почки. Для пациентов с высоким риском хирургического лечения или с соматическими противопоказаниями к операции возможно рассмотреть альтернативный вариант лечения — стереотаксическая лучевая терапия. В статье представлено клиническое наблюдение пациентки 63 лет, с диагнозом «Рак левой почки T1aN0M0, I стадия. ХБП С3а». В апреле 2021 года проведён курс стереотаксической лучевой терапии на опухоль почки до СОД 45 Гр. В июне 2022 года по поводу прогрессии ПКР выполнена резекция левой почки. Безрецидивная и онкоспецифическая выживаемость — 20 месяцев.
Инкрустирующий цистит представляет собой крайне редкую форму хронического воспаления мочевого пузыря, характеризующуюся кальцификацией стенки и ассоциированную с уреазопродуцирующими микроорганизмами, чаще всего с Corynebacterium urealyticum. Фермент уреаза запускает каскад расщепления мочевины на углекислый газ и аммиак, приводя тем самым к гипераммониурии и алкализации мочи уже в первые 24 часа. В таких условиях происходит гиперсатурация, благоприятная для формирования кристаллов струвитов и апатитов, инкрустирующих стенку мочевого пузыря. Наиболее значимыми предрасполагающими условиями и факторами риска для развития инкрустирующего цистита являются инородные тела в органах мочевыводящей системы, такие как уретральный катетер, нефростома, внутренние мочеточниковые стенты. Помимо этого, особое значение имеют эндоскопические операции на органах мочевыводящей системы в анамнезе. В данной статье мы представляем собственный клинический случай успешного лечения инкрустирующего цистита у мужчины после трансуретральной резекции предстательной железы.
ЛЕКЦИИ
Искусственный интеллект (ИИ) становится неотъемлемой частью современной медицины, включая урологию. В статье рассматриваются основные подходы к применению ИИ в диагностике, лечении урологических заболеваний. Акцент сделан на возможностях нейросетей, таких как свёрточные и рекуррентные, для анализа медицинских изображений, прогнозирования исходов и автоматизации рутинных задач. Особое внимание уделено применению алгоритмов глубокого обучения в выявлении и сегментации урологических патологий на УЗИ, КТ и МРТ. Рассматриваются успешные примеры использования ИИ в диагностике рака предстательной железы и мочевого пузыря, прогнозировании рисков осложнений, а также в разработке персонализированных терапевтических стратегий. Обсуждаются преимущества и ограничения ИИ в урологической практике, включая необходимость качественных данных для обучения моделей, проблемы интерпретации алгоритмов и вопросы этического характера. Статья содержит практические рекомендации для врачей-урологов, направленные на интеграцию ИИ в клиническую деятельность, подчёркивая роль технологий в улучшении качества медицинской помощи и повышении точности решений. Данные, представленные в статье, будут полезны для урологов, стремящихся интегрировать ИИ в клиническую практику, и подчёркивают важность сочетания технологий ИИ с клинической экспертизой для оптимального улучшения качества медицинской помощи. На пороге новой эры урологии те, кто первыми овладеют ИИ, не только изменят подходы к лечению, но и создадут будущее профессии.